|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Location:Home > テクニカル情報配信サービス > Pharma Mail |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
モノクローナル抗体精製の迅速なプロセス開発
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ステップ | 説明・目的 | カラム | バッファー |
|---|---|---|---|
| 1 | MabSelect SuRe™工程の溶出pHの決定 | HiScreen™ MabSelect SuRe™ | 20 mMクエン酸、pH 6.0~3.0 |
| 2 | MabSelect SuRe™の動的結合容量の決定 | HiTrap™ MabSelect SuRe™ | PBS(pH 7.4)およびクエン酸(pH 3.5) |
| 3 | MabSelect SuRe™を用いたMAb精製 | HiScreen™ MabSelect SuRe™ | PBS(pH 7.4)およびクエン酸(pH 3.5) |
| 4 | Capto™ adhereによるポリッシング工程用サンプルの準備(スケールアップ) | MabSelect SuRe™を充填したXK 50/20カラム(ベッド高=8.4 cm、Vc=165 ml) | PBS(pH 7.4)およびクエン酸(pH 3.5) |
| 5 | Capto™ adhereでの添加条件の決定 | HiScreen™ Capto™ adhere | 20 mMリン酸ナトリウム、20 mMクエン酸、pH 7.8~4.0 |
| 6 | 実験計画法(DoE)を用いたCapto™ adhereでの添加条件のスクリーニング | HiTrap™ Capto™ adhere | 20 mMリン酸ナトリウム、20 mMクエン酸、pH 7.5、6.75および6.0 |
| 7 | Capto™ adhereでの堅牢性の検討 | HiTrap™ Capto™ adhere | 50 mMリン酸ナトリウム、pH 6.95、6.75および6.55 |
実験計画法を用いたCapto™ adhere工程の添加条件のスクリーニング
電気伝導度、pH、サンプル添加量は、Capto™ adhereへのサンプル添加において重要なパラメーターです(参考文献1)。したがって、多くの異なる条件(要因)を同時に調べられるように実験系を準備することが望まれます。統計によってプロセスや目的物にもっとも大きく影響する要因を特定し明確にできるので、実験計画法(DoE)の利用が適しています。DoEでは、厳選した一連の実験を通じて、関連する全ての要因を同時に変動させて評価し、最大限の情報を得ることができます。メソッドの至適化では、DoEを利用することで最適な精製条件を定められる確率が高まります。
本研究では、Capto™ adhereのサンプル添加条件のスクリーニングに、UNICORN™ 6に組み込まれた全実施実験要因計画法(FFD: Full Factorial Design法)を用いました(表1、ステップ6)。3つのパラメーター、サンプル添加量、電気伝導度、pHを含む全実施実験要因計画法では、23=8実験と3つの中央値から、合計11実験となります(表2)。中央値は、サンプル添加量が192 mg/ml担体、電気伝導度20 mS/cm、pH 6.75となります。開始時の濃度は10.8から11.7 mg MAb/mlの間で変動し、HCPは平均45 ppm、Protein Aは2 ppm、D/Aが1.9%でした。
MAbの溶出濃度はpHに依存し約pH 5.79で最大となり、通常はこのような実験系ではさらに低い値で最大となります。しかし、今回は、低pHおよび低電気伝導度(< 10 mS/cm)でサンプルの沈殿が認められたため、電気伝導度を10 mS/cm以上に維持し、pHの下限は6.0としました。pHの上限については、通常溶出pHよりも2高い値が選択されますが、今回の例ではpH 7.5としました。電気伝導度は10~30 mS/cm、添加量は100~300 mg MAb/ml担体としました。
| DoE no. | Run order no. | 添加量(mg/ml担体) | 添加条件(mS/cm) | 添加pH | 回収率(%) | HCP (ppm) | Protein A (ppm) | D/A (%) |
|---|---|---|---|---|---|---|---|---|
| DoE 1 | 8 | 100 | 10 | 6.0 | 82.3 | 9 | < 1 | 0.93 |
| DoE 2 | 1 | 301 | 10 | 6.0 | 98.0 | 31 | < 1 | 0.67 |
| DoE 3 | 10 | 104 | 30 | 6.0 | 72.6 | 10 | < 1 | 0.65 |
| DoE 4 | 7 | 312 | 30 | 6.0 | 96.4 | 16 | < 1 | 0.86 |
| DoE 5 | 6 | 93 | 10 | 7.5 | 49.0*1 | 8 | < 1 | 0.22 |
| DoE 6 | 3 | 282 | 10 | 7.5 | 92.9 | 26 | < 1 | 0.65 |
| DoE 7 | 11 | 102 | 30 | 7.5 | 70.3 | 10 | < 1 | 0.49 |
| DoE 8 | 9 | 307 | 30 | 7.5 | 93.2 | 22 | < 1 | 1.04 |
| DoE 9*2 | 5 | 192 | 20 | 6.75 | 92.2 | 13 | < 1 | 0.86 |
| DoE 10*2 | 4 | 192 | 20 | 6.75 | 95.1 | 13 | < 1 | 0.81 |
| DoE 11*2 | 2 | 192 | 20 | 6.75 | 93.4 | 12 | < 1 | 0.69 |
*1: DoE 5では異常値を除外
*2: DoE 9~11は中央値(添加量192 mg/ml、伝導度20 mS/cm、pH 6.75)
Capto™ adhere工程の堅牢性の検討
スクリーニングDoEから求めた条件の周辺で、pH、電気伝導度、添加量を変動させ堅牢性を調べました。また、2つの異なるフィード液と担体については2つの異なるロットで検討しました。
どちらのフィード液もスクリーニングDoEで用いたフィード液より高濃度の不純物を含んでいました。5つのパラメーターで構築した減数実験、8実験と3つの中央値の合計11実験を設定しました(表3)。2つのフィード液の開始サンプル濃度は、12.7~14.7 mg MAb/mlで変動し、HCPはどちらも80 ppmでした。Protein Aはフィード1では3 ppm、フィード2では4 ppmでした。D/A は、フィード1では平均5.3%、フィード2では3%でした。DoE 9~11は中央値(添加量200 mg/ml、電気伝導度15 mS/cm、pH 6.75)です。
| DoE no. | Run order no. | 添加量 (mg/ml担体) |
添加条件 (mS/cm) |
添加pH | クロマトグラフィー 担体のロット |
サンプルの フィード |
回収率(%) | HCP (ppm) | Protein A (ppm) | D/A (%) |
|---|---|---|---|---|---|---|---|---|---|---|
| DoE 1 | 2 | 190 | 17 | 6.55 | A | Feed 2 | 86.7 | 20 | < 1 | 2.3 |
| DoE 2 | 9 | 210 | 13 | 6.55 | A | Feed 1 | 93.9 | 55 | 2 | 1.2 |
| DoE 3 | 3 | 190 | 17 | 6.95 | A | Feed 1 | 76.1 | 25 | < 1 | 1.7 |
| DoE 4 | 10 | 210 | 13 | 6.95 | A | Feed 2 | 83.7 | 55 | 2 | 1.5 |
| DoE 5 | 4 | 190 | 13 | 6.55 | B | Feed 2 | 86.4 | 25 | < 1 | 2.1 |
| DoE 6 | 5 | 210 | 17 | 6.55 | B | Feed 1 | 85.3 | 55 | 2 | 1.3 |
| DoE 7 | 7 | 190 | 13 | 6.95 | B | Feed 1 | 78.1 | 15 | < 1 | 1.9 |
| DoE 8 | 6 | 210 | 17 | 6.95 | B | Feed 2 | 88.3 | 25 | < 1 | 2.2 |
| DoE 9*1 | 1 | 200 | 15 | 6.75 | A | Feed 1 | 81.9 | 20 | < 1 | 2.5 |
| DoE 10*1 | 8 | 200 | 15 | 6.75 | A | Feed 1 | 85.4 | 55 | 1 | 1.7 |
| DoE 11*1 | 11 | 200 | 15 | 6.75 | A | Feed 1 | 83.2 | 25 | < 1 | 2.4 |
*1: DoE 9~11は中央値(添加量200 mg/ml、伝導度15 mS/cm、pH 6.75)
収量、HCPクリアランス、凝集体量、Protein A漏出の測定
回収率と濃度の測定
濃度測定は波長280 nmのUV測定(吸光係数は1.49)か、ÄKTA™explorer 10とHiTrap™ MabSelect SuRe™ 1 mlカラムを用いたアフィニティークロマトグラフィーで行いました。
二量体・凝集体の分析
素通り画分は、相互に接続した2本のSuperdex™ 200 5/150 GLカラムとÄKTA™explorer 10を用いたゲルろ過(サイズ排斥クロマトグラフィー)で分析しました。分取したサンプルをカラムに添加し、PBSを用いて流速0.35 ml/minで15分間流しました。凝集体濃度は、波長280 nmのUV測定を行い、ピークエリア比を計算することで算出しました。
宿主細胞由来タンパク質(HCP)とリガンド漏出の分析
HCP濃度は市販の抗CHO HCP抗体(Cygnus Technologies Inc.)を用いて測定しました。基本的にはELISA法で、Gyros AB(Uppsala, Sweden)のGyrolab Bioaffy 20 HCマイクロラボラトリーディスクを用いて、Gyrolab Workstation LIFで行いました。リガンドの漏出(MabSelect SuRe™ Protein Aリガンド)測定には、市販のELISAキット(Repligen Corp., Waltham, MA, USA)を使用し、プロトコールには若干の改変を加えました。
SDS-PAGE分析
サンプルは1M NaOHを用いてpH 8.5に合わせました。ジメチルホルムアミドを用いてCyDye™ DIGE Fluor minimal dye(Cy5)の溶液を調製しました(12.5 μlのジメチルホルムアミド中に5 nmolのCyDye™)。50 μgのタンパク質に1 μlのCy5溶液を添加し、遮光して氷上で30分間インキュベーションしました。1 μlの10 mMリジンを添加して反応を停止しました。非還元サンプル(5 μg/well)を ExcelGel™ SDS Gradient 8-18プレキャストゲルとMultiphor II水平型電気泳動システムを用いて泳動しました。ゲルのスキャンにはEttan™ DIGE Imagerを使用しました。MAbおよび不純物の量がかなり異なることを考慮し、PMT(光電子増倍管)の電圧は複数の異なる設定を用いました。
結果と考察
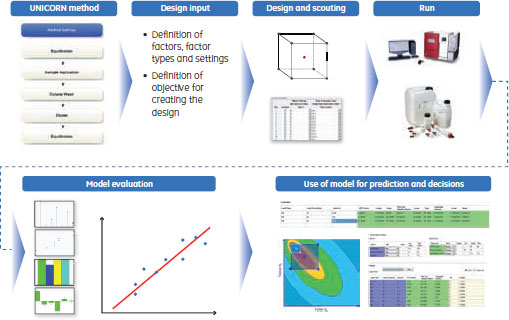
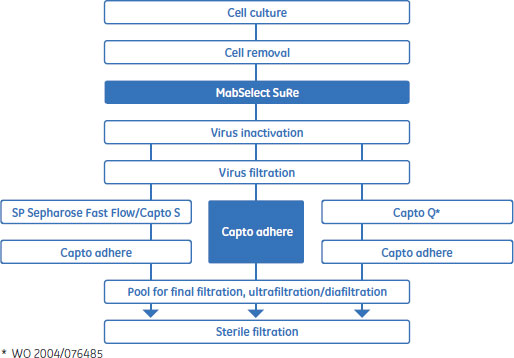
2段階精製はProtein A担体によるキャプチャー工程とマルチモーダル陰イオン交換によるポリッシング工程からなるプロセスです。ÄKTA™ avant 25と制御ソフトウェアUNICORN™ 6を使うと、プロセスの開発は約1週間で完了しました。開発したメソッドでは、高純度のMAbを高い効率で回収できました。今回達成された純度はほとんどの治療用医薬品において十分なものと思われますが、さらに純度を高めるには、3段階精製を行うこともできます。
今回の材料は、主にサンプルの沈殿の問題から、2段階目の実験条件において、高い電気伝導度の設定をを余儀なくされる、難易度の高いものでした。
通常、電気伝導度が低い方が不純物の除去には有利です(参考文献1)。時間が経過した場合とpHが低い場合に、MAbが凝集してしまう点も、今回の材料の難点でした。その結果、最初の実験に使ったサンプルのD/Aは、後の実験、例えば堅牢性の検討に使ったサンプルよりも低くなりました。
MabSelect SuRe™を用いたMAbのキャプチャー
MabSelect SuRe™での溶出pHと動的結合容量の決定
MAbの溶出はpHのリニアグラジエントで行いました(図3)。ピーク最大値の溶出pHは3.67で、pH 3.56ではピーク最大値の10%になりました(減少傾向)。この結果から、収量を高め溶出ピークを狭くするために、溶出pHは3.5としました。10% breakthroughにおける動的結合容量(DBC 10%)は、滞留時間2.4分と4分で、それぞれ21、40 mg/mlとなりました。
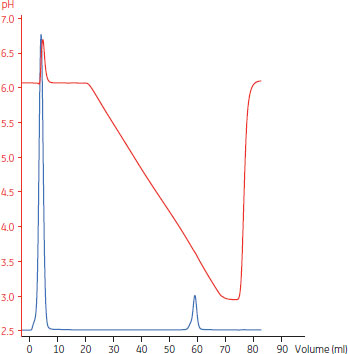
図3.HiScreen™ MabSelect SuRe™を用いた溶出pHの決定
| カラム | HiScreen™ MabSelect SuRe™, 4.7 ml |
|---|---|
| サンプル | 1.72 mg MAb/mlのMAbを含む清澄化CHOフィード液、1 ml |
| 結合バッファー | 20 mMクエン酸、pH 6.0 |
| 溶出バッファー | 20 mMクエン酸、pH 3.0 |
| グラジエント | リニア、20 mMクエン酸バッファー、pH 6.0~3.0、10カラム体積 |
| 流速 | 0.5 ml/min |
| 精製装置 | ÄKTA™ avant 25 |
MabSelect SuRe™を用いたMAbの精製
図4は、HiScreen™ MabSelect SuRe™カラムでMAbを精製した際のクロマトグラムの例です。回収率は99%に達し、HCPは25 ppm、D/Aは0.8%、Protein Aは6 ppmでした。
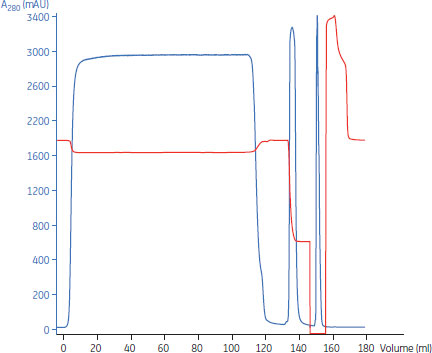
図4.HiScreen™ MabSelect SuRe™を用いたMAbの精製。素通り画分の後の最初のピークは精製されたMAb、2番目のピークはCIPの不純物を含む。pH(赤)の顕著な低下は、NaOHの添加中にpHの測定を省略した結果。この付近のpH変化は実データと異なる。
| カラム | HiScreen™ MabSelect SuRe™, 4.7 ml |
|---|---|
| サンプル | 1.17 mg MAb/mlのMAbを含む清澄化CHOフィード液、112.5 ml |
| 結合バッファー | PBS, pH 7.4 |
| 溶出バッファー | 50 mMクエン酸、pH 3.5 |
| 流速 | 1.2 ml/min、滞留時間4分 |
| グラジエント | 1段階、結合バッファーから溶出バッファーへ |
| 定置洗浄(CIP) | 0.1 M NaOH、2カラム体積、接触時間15分 |
| 精製装置 | ÄKTA™ avant 25 |
Capto™ adhereによるポリッシング工程前のXK 50/20を用いたスケールアップ
ポリッシング工程の実験に用いる材料を調製するために、メソッドをXK 50/20カラムでスケールアップしました(データなし)。スケールアップはÄKTA™explorer 100を用いて行いました。XK 50/20で精製した抗体をプールし、Capto™ adhereを用いたスクリーニングと堅牢性の検討に使用しました。XK 50/20での精製では、スケールアップ前に比べて、HCP、Protein A、D/Aともに若干高い値になりました。
Capto™ adhereによるポリッシング工程
結合および溶出条件の初期スクリーニング
pH 7.8で3 mgのMAbをHiScreen™ Capto™ adhereカラムに添加し、pH 7.8から4.0のリニアグラジエントで溶出しました。MAbは比較的幅広いピークで溶出されました(図5)。ピーク最大値の溶出pHは5.79でした。さらに至適化した場合、溶出位置はより低pH側になりますが、pHと伝導度が低い場合には沈殿を生じるというサンプルの性質から、pHの下限は6.0に設定し、電気伝導度は≥10 mS/cmに保ちました。
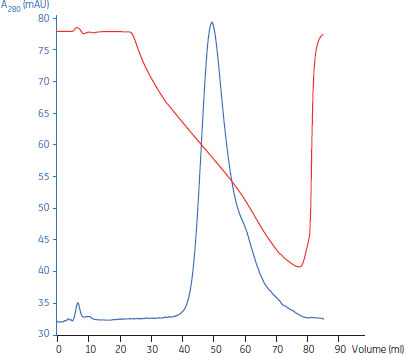
図5.HiScreen™ Capto™ adhereの結合および溶出条件の決定
| カラム | HiScreen™ Capto™ adhere, 4.7 ml |
|---|---|
| サンプル | HiScreen™ MabSelect SuRe™の溶出プール1 mlを開始バッファーで3 mg/mlに希釈 |
| 開始バッファー | 20 mMリン酸ナトリウム、20 mMクエン酸、pH 7.8 |
| 溶出バッファー | 20 mMリン酸ナトリウム、20 mMクエン酸、pH 4.0 |
| グラジエント | リニア、20 mMリン酸、20 mMクエン酸、pH 7.8~4.0、10カラム体積 |
| 流速 | 2.4 ml/min |
| 精製装置 | ÄKTA™ avant 25 |
添加条件スクリーニングの実験計画法
図6はHiTrap™ Capto™ adhereを用いたスクリーニングデザインの典型的な素通り画分のクロマトグラムです。MAbは素通り画分に溶出しています。このデザインによるデータの要約は表2に示しています。このクロマトグラムはDoEスクリーニングの中央値のデータです(表2)。
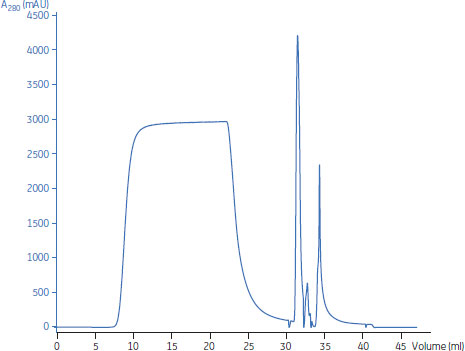
図6.HiTrap™ Capto™ adhereを用いたスクリーニングデザインのクロマトグラム。MAbは素通り画分に溶出し、32 ml、35 ml付近の2つのピークは凝集体とCIPに由来する不純物。
| カラム | HiTrap™ Capto™ adhere, 1 ml |
|---|---|
| サンプル | HiScreen™ MabSelect SuRe™の溶出プール(デザインの中央値、pH 6.75、伝導度15 mS/cm、添加量200 mg/ml担体) |
| 開始バッファー | 20 mMリン酸ナトリウム、20 mMクエン酸、pH 6.75。NaClを用いて伝導度を15 mS/cmに調整 |
| 再生バッファー | 0.1 M酢酸、pH 3.0 |
| グラジエント | 開始バッファー、再生バッファー、CIPのステップグラジエント |
| 流速 | 2.0 ml/min |
| CIP | 1 M NaOH、接触時間15分 |
| 精製装置 | ÄKTA™ avant 25 |
スクリーニングDoEの結果を図7に示します。結果は「Summary of fit(当てはまりの概要)」「Coefficient plot(係数プロット)」「Contour plot(等高線図)」の3つの方法で図示しました。回収率、HCPの除去、凝集体(D/A)の除去の3つの応答を分析しました。4つ目の応答、Protein Aの漏出については、統計モデルを用いたデザインを行うには低すぎました。実際、HiScreen™ MabSelect SuRe™の溶出画分のProtein A漏出は、非常に低い値でした。
Summary of fitプロットでは、モデルから導かれる応答の百分率変化(R2)が回収率、凝集体モデルともに>0.8であり、モデルによく当てはまっていることを示しています。交差検定によると、モデルから予測される応答の百分率変化(Q2)は>0.5であり、これらの要因については、モデルに高い予測能力(Predivtive power)があることが確認できました。モデルの妥当性(Model validity)の値が0.5以上であると、有力なモデルであり、最良のモデルでは0.9を超えます。HCPの除去については、モデルの質はそれほどではなく、妥当性も不十分でした。このモデルに関して、繰り返し変動を測定して得られた再現性(Reproducibility)の値は0.5以上で、エラーが少なく、実験手順のコントロールが良好であることを示しています。
Coefficient plotは信頼区間で回帰係数を示した図です。有意な係数および相互作用項に有意性であっても、単独では有意でない係数がモデルの中に残りました。
Contour plotは特定の応答に対する2つの要因の影響を示しています。
予想通り、添加量の増加は回収率に正の影響を与える一方、不純物のクリアランスは添加量を下げることで改善されました。
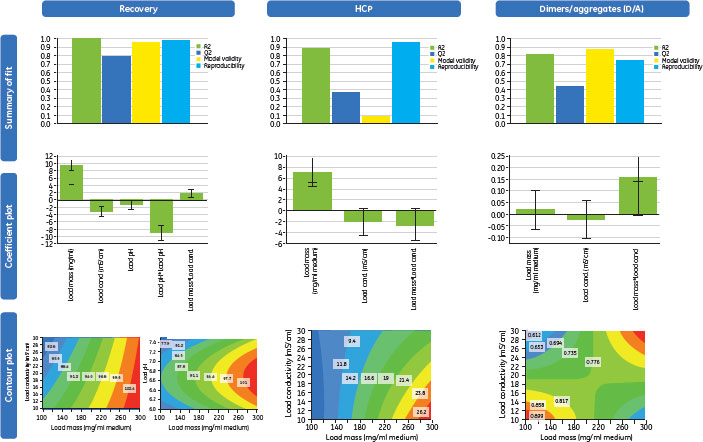
図7.Capto™ adhereステップの条件スクリーニングについてのDoEの結果。回収率、HCP、D/Aの3つの反応をそれぞれ分析。結果は「Summary of fit(当てはまりの概要)」「Coefficient plot(係数プロット)」「Contour plot(等高線図)」の3つの方法で図示。ここをクリックすると拡大します。
Capto™ adhereでの堅牢性実験
結果を表3に示します。図8は個々のDoEと2種類のフィード液のSDS-PAGEの結果で、図9は堅牢性検討のSummary of fitです。得られた結果はどのモデルにも当てはまらなかったため、この条件は堅牢であると見なされました。この結果は、DoE実験のSDS-PAGEの結果(合計11レーン)に明白な差が見られなかったことも、この判断を裏付けています(図8)。
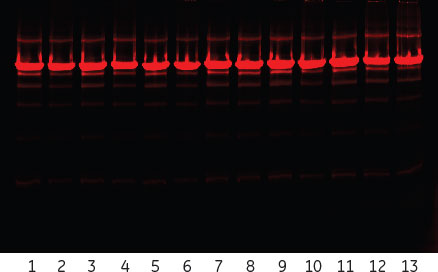
図8.堅牢性DoEのSDS-PAGE。ExcelGel™ SDS Gradient 8-18を用いて非還元状態で泳動。ゲルはCy5で染色。レーン1-11はそれぞれのDoEの実験番号に対応。レーン12、13はフィード1および2。
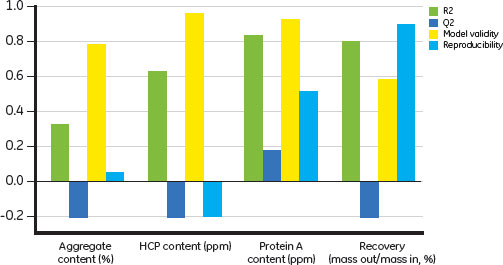
図9.DoE堅牢性実験のフィットの概要。D/A、HCP、Protein A含量、回収率の結果。
まとめ
ÄKTA™ avant 25、UNICORN™ 6とプレパックのHiTrap™およびHiScreen™カラムを用い、およそ1週間で2段階のクロマトグラフィープロセスを開発できました。ÄKTA™ avant 25、UNICORN™ 6、MabSelect SuRe™およびCapto™ adhereプレパックカラムで、直接的にメソッドの至適化をすることができました。ÄKTA™ avant 25は標準の流路を変更することができる大変柔軟な装置です。本研究では、2つのサンプルインレットバルブを活用して、自動サンプル添加およびサンプル損失のない洗浄を行いました。最新の圧力・流速制御機能を利用することで、サンプル添加中の圧力上昇を最小限に抑えることができました。Capto™ adhereのポリッシング工程の条件検討において、DoEはたいへん有効でした。UNICORN™ 6のDoEモジュールは最適かつ堅牢な条件を見つけるためのスキームの組立てを容易にし、生産性の向上に貢献します。
参考文献
- Application note: Optimization of loading conditions on Capto™ adhere using Design of Experiments, 28-9078-89 Edition AA, Cytiva.
- Eriksson, K. et al. MAb contaminant removal with a multimodal anion exchanger. A platform step to follow protein A. BioProcess™ International, 7 (2) 52.56 (2009).
Cytivaのプロセス開発ワークフロー
CytivaのBioProcess™システム、クロマトグラフィー担体、カラム、96ウェルプレートは、キャプチャーからポリッシングまですべての精製ステップをカバーしており、また、開発やパイロット実験から製造まですべてのスケールをカバーしています。ÄKTA™ avant 25の流速および圧力はMabSelect™やCapto™などのBioProcess™担体の使用に適しています。これらのBioProcess™担体は、高流速でも大きな動的結合容量をもっています。ÄKTA™ avant 25、UNICORN™コントロールソフトウェア、そして高流速のBioProcess™担体を組み合わせることで、プロセスの時間短縮、生産性向上、容易なスケールアップを実現できます。
担体はすべて検証済みの方法で製造され、厳密な品質規格に合致しているか試験済みです。
確実な受注・配送により、製造スケール用担体を安定供給します。プロセスの検証と規制当局への申請に役立つRegulatory Support File(RSFs)もご用意しています。

お問合せフォーム
※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。
お問い合わせありがとうございます。
後ほど担当者よりご連絡させていただきます。
© 2026 Cytiva