|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Location:Home > テクニカル情報配信サービス > Pharma Mail |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
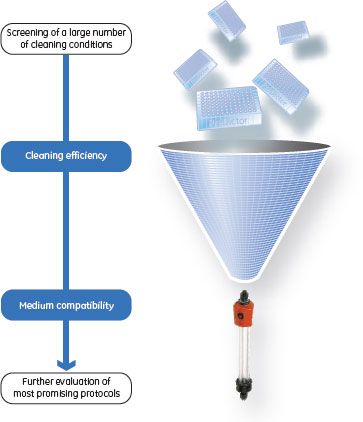
定置洗浄(CIP)プロトコールのためにデザインされたハイスループットプロセス開発バイオ医薬品製造におけるクロマトグラフィー担体の定置洗浄(Cleaning-in-place、CIP)は、最終製品の品質と安全性に非常に重要です。担体の効率的な洗浄が実施できれば、カラム寿命が延びるため、精製プロセスの費用対効果が改善します。本稿では、クロマトグラフィー担体があらかじめ分注されているPreDictor™ 96ウェルフィルタープレートを使用して、数多くの洗浄剤と洗浄ステップの順序を評価を1枚のプレートで行った結果について記載します。培養上済フィード液を使用してPreDictor™プレートを使用した一連のクロマトグラフィーのサイクルを繰り返し、CIP洗浄を実施した後、ビーズに残存するタンパク質の量を分析し、さまざまな洗浄剤と洗浄ステップの順序を評価しました。このアプリケーションではモノクローナル抗体(MAb)の製造プロセスに使用されるMabSelect SuRe™のCIP条件のスクリーニングについて述べていますが、この方法論は一般的なものであり、ほとんどのクロマトグラフィー担体とフィード液の組み合わせにも適用できます。 バイオ医薬品製造プロセスのダウンストリーム精製において、クロマトグラフィーカラムのCIPは最終製品の品質と安全性に重要です。フィード液の供給源によっては、除去されなかったさまざまな種類の不純物がクロマトグラフィー担体に吸着してしまい、次のサイクルへのキャリーオーバーの原因となる可能性があります。キャリーオーバーする物質としては製品としての抗体または抗体由来物質が考えられますが、これらの他に宿主細胞タンパク質、核酸、レトロウイルス粒子、プロセスの添加剤および脂質がキャリーオーバーされる可能性もあります(1)。 効率的なカラム洗浄プロトコールは、プロセスの費用対効果向上に貢献します。汚染物質の段階的な蓄積を防ぐことによって、カラムの寿命を延ばすことができます。カラムの再利用または廃棄の判断はプロセスエコノミーの観点から考えられ、ユニット・オペレーションのスケール、担体のコスト、担体の洗浄剤との適合性などといった多くの要素によって左右されます。たとえば、大きなスケールのProtein Aのカラムでは一般的に再利用が妥当と考えられますが、小さなイオン交換カラムでは使い捨てが妥当と考えられる場合もあります(2)。
カラム洗浄条件クロマトグラフィーカラムの洗浄および殺菌に最も一般的に利用される洗浄剤は水酸化ナトリウムですが、一部のクロマトグラフィー担体は水酸化ナトリウムの洗浄に適していません。水酸化ナトリウムによって不安定になるクロマトグラフィー担体の例としては、(1)タンパク質リガンドを使用しているアフィニティークロマトグラフィー担体、(2)シリカまたはガラスベースのクロマトグラフィー担体が挙げられます。最近の技術進歩により、これらの担体の使用制限はある程度軽減されてきています。MabSelect SuRe™はアルカリ条件に安定なrProtein Aリガンドを使用しており、通常CIPプロトコールに用いられるアルカリ条件下での安定性が従来のProtein A担体と比べて向上しています。また、MabSelect SuRe™はアルカリ条件に安定なアガロースをベースマトリックスとして使用しています。 従来のカラム・ライフタイム試験では、非常に長い時間と多くの試薬を必要としました。カラムクロマトグラフィーの1サイクルでは、1つの洗浄条件しか検討できません。本実験では、担体の洗浄効率と適合性について、各種CIP試薬と洗浄ステップを評価する方法としてPreDictor™ 96ウェルフィルタープレートを使用しています。一定量のクロマトグラフィー担体があらかじめ分注されているPreDictor™ 96ウェルフィルタープレートを利用して、CIP条件のスクリーニングを行いました。その後、担体の性能に対する洗浄の効果を評価する目的で、選ばれたCIPプロトコールを従来のカラムを用いて検証しました。 本研究はMAb製造プロセスに使用されるMabSelect SuRe™の洗浄効率の検討を目的としていますが、この方法は一般的なものであり、あらゆるクロマトグラフィー担体とフィード液の組み合わせによるCIPプロトコールのデザインにも適用できます。この方法はタンパク質不純物の洗浄効率を評価するために開発されましたが、その他の不純物の洗浄効率評価にも拡張できました。 材料および方法PreDictor™プレートを用いて行う洗浄条件のスクリーニングこの方法は3つのステップからなります。最初のステップでは、洗浄操作を行わずMAbフィード・サンプルの添加と溶出を繰り返すことによってPreDictor™プレート内の担体を汚染します。次のステップでは、ウェル内の汚染された担体に各種洗浄剤をさまざまな濃度で添加し、一定時間インキュベート後に洗浄剤を除去します。最後のステップでは、洗浄後の担体に残存している不純物を分析します。これにより決められたCIP条件は、その後のカラムを用いたライフタイム試験により検証しました。 担体の汚染および洗浄条件のスクリーニングは、オートピペット操作と手動の遠心分離または吸引ろ過によるマニュアルなワークフローでも実施できますし、Tecan™などの自動化ロボットシステムで実施することも可能です。ここでは一般的な手順について説明します。
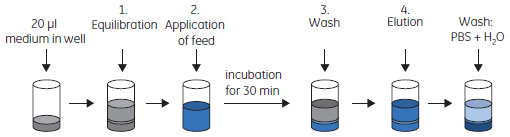
PreDictor™ MabSelect SuRe™中の担体の汚染PreDictor™ MabSelect SuRe™ 20 µlを使用しました。上面のシールに付着している担体粒子を再懸濁するために、PreDictor™プレートの上下を指示書(3)にしたがって数回反転させました。 以下の各ステップでは、PreDictor™プレートをマイクロ・プレート・シェーカー上で、1100 rpmで短時間混合させました。PreDictor™プレートの底面の付いている水滴のコンタミを防ぐため、ワークフロー全体を通してPreDictor™プレートをCollection plateの上に置きました。混合中は、PreDictor™プレートとCollection plateを互いに固定してマイクロ・プレート・シェーカーに取り付けました。以下の各ステップ間のPreDictor™プレート・ウエル中から液体を除去する際には、遠心分離(500×g、1分間)または真空ろ過(160 mbarで30秒間の後、300 mbarで3秒間)条件を使用しました。実験を開始する前に、ウエル内の保存溶液(20%エタノール)を除去しました。
* 自動化された手順では、毎回液体を除去した後でPreDictor™プレートをクッションプレートの上に置いてプレートの底を拭き取りました。クッションプレートは、フィルターを取り付けて使用するTecan™専用アクセサリーの「ろ紙ホルダー」です。 10回のカラム・クロマトグラフィー・サイクルとして、上記のステップ1~4を10回繰り返し、すべての液体画分を廃棄しました。サイクルの手順にサイクル終了後の洗浄工程は含めませんでした。最終サイクルの溶出後、PreDictor™プレートをウェルあたりPBS 200 µlで3回再平衡化した後、超純水200 µlで1回洗浄し、スクリーニング手順を実施するまで超純水200 µl中で保存しました。
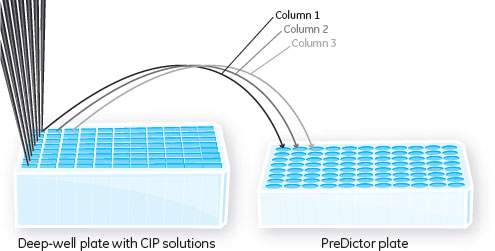
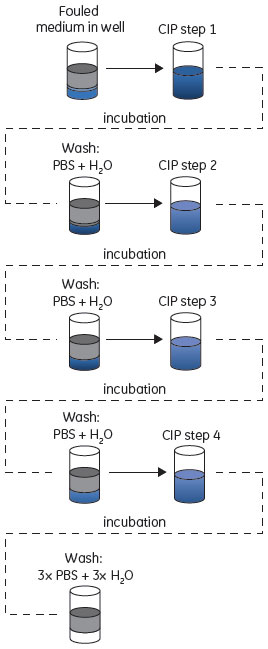
洗浄条件のスクリーニング対照(PBSによる洗浄)を含む32種の洗浄プロトコールの洗浄効率を評価しました。 2番目の洗浄ステップでは、以下に示す溶液のいずれか1つを使用しました。
3番目の洗浄ステップは、6 Mグアニジン塩酸塩(Gua-HCl)やさまざまな濃度(0.1~0.5 M)の水酸化ナトリウムまたは超純水による洗浄としました。MabSelect SuRe™は0.1 M水酸化ナトリウムにより接触時間15分で最大200サイクルまで洗浄可能で、結合容量(> 90%)を維持できます。また、0.5 M水酸化ナトリウムによる最大60サイクルまでの洗浄も可能です(4)。 4番目の洗浄ステップとして、0.1 Mクエン酸ナトリウム(pH 3.0)による洗浄を含めてもよいことにしました。この最後の酸性バッファーによる洗浄ステップが含まれないプロトコールについては、代わりに担体を超純水で洗浄しました。 PreDictor™プレート上で各CIPプロトコール(1~32)を3セット重複して検討しました(図4)。
表1. 対照(PBSによる洗浄)を含む32種類の洗浄プロトコールの洗浄効率を評価しました。還元剤を含む溶液の組成は以下の通りです:50 mMまたは100 mM 1-チオグリセロール、25 mM Tris、0.15 M NaCl、25 mM KCl、1 mM EDTA(pH 8.5)または100 mM DTT、25 mM Tris、0.15 M NaCl、25 mM KCl。試薬が示されていないCIPステップについては、超純水を添加しました。
*EDTAを含まず 以下の各ステップでは、PreDictor™プレートをマイクロ・プレート・シェーカー上で、1100 rpmにて短時間混合させました。混合中は、PreDictor™プレートとCollection plateを互いに固定してマイクロプレートシェーカーに取り付けました。以下の各洗浄(PBS、超純水)およびCIPステップ間でPreDictor™プレートから液体を除去する際には、遠心分離(500×g、1分間)または真空ろ過(160 mbarで30秒間の後、300 mbarで3秒間)を利用しました。スクリーニング手順を開始する前に、汚染したPreDictor™ MabSelect SuRe™から超純水を除去しました。プレートは汚染操作後にプレート上部を上にして水平に保管し、プレートの反転は行いませんでした。
* 自動化された手順では、毎回液体を除去した後でPreDictor™プレートをクッションプレートの上に置いてプレートの底を拭き取りました。クッションプレートは、フィルターを取り付けて使用するTecan™専用アクセサリーの「ろ紙ホルダー」です。 以上のステップではすべての液体画分を廃棄しました。
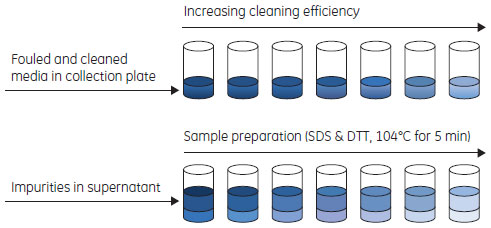
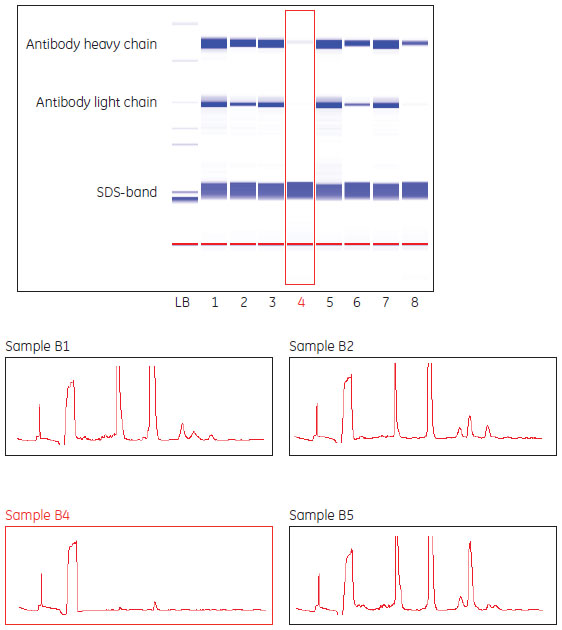
洗浄後の担体に残存しているタンパク質不純物の分析分析法の自動化およびハイスループット処理が可能であることから、マイクロチップ電気泳動を使用(Caliper Life SciencesのCaliper LabChip 90、HT Protein assay 100)しました。Caliper DataViewerソフトウェアを使用すれば半定量データが得られ、数百のデータポイントを評価することができます。Caliperシステムを利用できない場合には、従来のSDS-PAGEを利用して残存不純物を分析することも可能です。 マイクロチップ電気泳動による分析用のサンプルを調製するため、Collection plateを実験に供したPreDictor™プレート上にさかさまに置き、水気を切った担体サンプルをCollection plateに移しました。2枚のプレートを輪ゴムで固定後に上下反転し、遠心分離(972 エ・g、5分間)によって担体をPreDictor™プレートからCollection plateに移しました。 Tris 3 gを超純水40 mlに溶解し、氷酢酸でpH 7.5に調整し、超純水を加えて最終容量を50 mlにしました。SDS 0.5 gをこのTrisバッファー5 mlに溶解し、超純水を加えて容量を50 mlに調整しました(SDSバッファー)。サンプルバッファーは、SDSバッファー25 mlと1 M DTT 1.39 mlを混合し、超純水を加えて容量を50 mlに調整することによって調製しました。 Collection plateの各ウェル内の担体に、サンプルバッファー(100 µl)を添加しました。プレートをマイクロ・プレート・ホイルで覆い、マイクロプレートシェーカー上で、1100 rpmにて短時間混合させた後、プレートを104℃の加熱チャンバーまたは加熱ブロック内で5分間加熱しました。Collection plateを再度1100 rpmで短時間混合させた後、遠心分離(500×g、2分間)によりクロマトグラフィー担体をスピンダウンしました。マイクロチップ電気泳動による分析を行うため、担体から移行したタンパク質不純物が含まれている上清40 µlをPCRプレートに分注しました。 HT Protein LabChip Kit User Guide(5)にしたがってCaliper HT Protein Expressチップを準備しました。Caliper Life SciencesのCaliper LabChip 90上で「HT Protein assay 100 high sensitivity」を実施し、CaliperソフトウェアDataViewerを使用してデータの評価をしました。
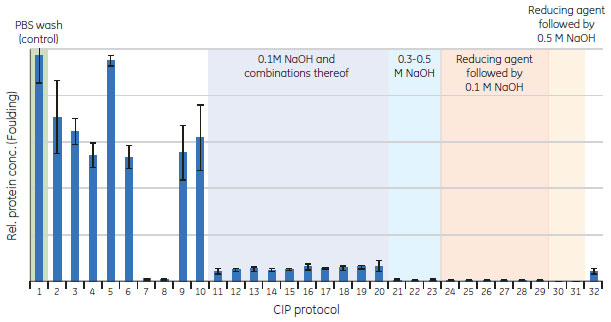
得られた洗浄条件のカラムでのライフタイム試験による検証プレートで得られたCIPプロトコールを従来のカラムを用いたライフタイム試験により検証しました。MabSelect SuRe™を充填したTricorn™ 5/50カラムとÄKTA™explorer 10システムを用いて実施しました。 清澄化後のMAb含有CHO細胞培養液をMabSelect SuRe™ 1 mlあたりMAb 28 mgとなるように添加しました。これは、ダイナミックキャパシティー(10% breakthough)の80%に相当します。洗浄の後MAbを溶出し、続いて各サイクルの最後に接触時間15分でCIPを行いました。これを150サイクル実施し、10サイクルごとにフィード液を添加しないブランクサイクルを実施しました。MAbおよび宿主細胞タンパク質のキャリーオーバーを分析するため、溶出液(すなわち、実際のサイクルで溶出ピークが検出されると予測できる位置での溶液)を回収しました。 結果ハイスループット・フォーマットを利用した洗浄条件のスクリーニングCIPプロトコールのデザインにMabSelect SuRe™ PreDictor™プレート20 µl(MabSelect SuRe™担体があらかじめ分注されている96ウェルフィルタープレート)を使用しました。MAbフィードによってウェル内の担体を汚染後、さまざまなCIP剤中でインキュベートしました。最大で4つの洗浄ステップからなる32種類のCIPプロトコールについて、タンパク質不純物の洗浄効率を評価しました。マイクロ・チップ電気泳動を利用して、洗浄後の担体に残存しているタンパク質不純物を分析しました。きれいに洗浄された担体サンプルは効率的に洗浄できていることを示します。(図7および図8)。Caliperソフトウェアによって得られた半定量データを利用して、さまざまなCIPプロトコールの洗浄効率を評価しました。 MabSelect SuRe™は0.1 M水酸化ナトリウムによって効率的に洗浄されました(CIPプロトコール11;図9)。0.1 M水酸化ナトリウムを酸性バッファーによる洗浄ステップ、溶媒、アルコールやカオトロピック試薬と組み合わせても、より高い洗浄効率を得ることはできませんでした(CIPプロトコール12~20)。0.3~0.5 M水酸化ナトリウムを用いた場合(CIPプロトコール21~23)または還元剤(50~100 mM 1-チオグリセロールまたは100 mM DTT)の後に水酸化ナトリウムを用いた場合(CIPプロトコール24~31)には、さらに高い洗浄効率が得られました。50 mMまたは100 mM 1-チオグリセロールで洗浄した場合の差異は観察されませんでした。100 mM還元剤で洗浄後、0.5 M水酸化ナトリウムで洗浄した場合には、担体に残存していたタンパク質不純物の痕跡は検出されませんでした(CIPプロトコール30および31)。2つのステップの順序を逆にして0.1 M水酸化ナトリウムの後に100 mM 1-チオグリセロールを用いた場合(CIPプロトコール32)の洗浄効率は、0.1 M水酸化ナトリウムのみを用いた場合と比べて改善されませんでした。100 mM 1-チオグリセロールの後に6 Mグアニジン塩酸塩を用いた場合にも非常に高い洗浄効率が得られました(CIPプロトコール7および8)*。100 mM 1-チオグリセロール単独では、タンパク質不純物をまったく洗浄できませんでした(CIPプロトコール5)。 * 米国特許No. 6972327(Immunex Corporation)
酸性バッファーによる洗浄のみ(pH 3.0[CIPプロトコール2]およびpH 2.5[CIPプロトコール3])では対照(CIPプロトコール1)と比べてわずかに高い洗浄効率が得られました。また、6 Mグアニジン塩酸塩のみ(CIPプロトコール4)および6 Mグアニジン塩酸塩と酸性バッファーによる洗浄ステップの組み合わせ(CIPプロトコール6)によっても対照と比べてわずかに高い洗浄効率が得られました。8 M尿素(CIPプロトコール9)および低pHにおける8 M尿素と1.0 M NaClの組み合わせ(CIPプロトコール10)によっても、対照と比べてわずかに高い洗浄効率が得られました。 ロボットシステムを利用して、プレートをフィード液で終夜汚染しました。手動操作では2日にわたって汚染しました。洗浄条件のスクリーニングは半日、マイクロチップ電気泳動を利用する残存不純物の解析も半日で実施可能でした。 カラムによるライフタイム試験により検証したCIP条件洗浄剤は洗浄効率だけではなく、担体との適合性、コスト、廃棄の問題および経験に基づいて選択されるべきです(1)。プレートを用いたスクリーニング結果によると、還元剤の後に水酸化ナトリウムまたは還元剤の後にグアニジン塩酸塩を用いる2ステップの洗浄手順による洗浄効率が最も高くなりましたが、カラムによるライフタイム試験によって検証する洗浄条件の候補としては、0.1 M水酸化ナトリウムを用いる1ステップの洗浄手順が選択されました。水酸化ナトリウムは廃棄の問題がない安価な化学物質です。MabSelect SuRe™は0.1 M水酸化ナトリウムに適合し、各サイクルの接触時間15分で最大200サイクルのCIPを実施後も結合容量が持続します(4)。さらに、1ステップのCIPならカラムメンテナンスプログラムを可能な限り短く保つことができます。 選択された洗浄条件のカラム寿命試験による検証接触時間15分のCIPを150サイクル実施したカラムのライフタイム試験において、0.1 M水酸化ナトリウムの使用は良好な結果が得られました。抗体回収率収率は全体を通して95%~100%の範囲内で一定、HCPの濃度は1000~1500 ppmの範囲内で一定していました。サイクル間で検出可能なキャリーオーバーは認められませんでした(< 10 ng/mL)。150サイクル後のダイナミック結合容量は初期値の85%を上回りました。試験終了後にカラムを分解し担体を調べたところ、使用したMabSelect SuRe™担体の変色や汚染は目視で観察されませんでした。 まとめMAb製造プロセスに使用されるMabSelect SuRe™は、水酸化ナトリウム(0.1~0.5 M)によって効率的に洗浄されました。還元剤の後に0.1~0.5 M水酸化ナトリウムを用いるCIPプロトコールは、より難しいフィードストックを使用する場合のオプションになり得ます。還元剤の後に低濃度(50 mM未満)の水酸化ナトリウムまたは還元剤の後に6 Mグアニジン塩酸塩を用いるCIPプロトコールは、組換えProtein Aリガンドを使用しているMabSelect™のようにアルカリ耐性があまり高くないアフィニティー担体を使用する場合のオプションになります。プレートを用いたCIPスクリーニング法はマニュアル操作でも実施できますし、Tecan™のロボットで手順を実施することもできます。本研究ではMAb製造プロセスに用いられるMabSelect SuRe™に関して洗浄条件のスクリーニングを行いましたが、この方法は一般的なものであり、あらゆる担体とフィードストックの組み合わせにも適用できます。プレートで決められたCIPプロトコールのカラムでの検証により、ハイスループット・フォーマットとカラム間の相関が非常に良好であることが示されました。従来のカラムのライフタイム試験では、1回に1条件しか評価できないという制限があったために、数百もの洗浄条件を評価することは不可能でしたが、ハイスループット法を使用すれば数百もの洗浄条件を数日以内にスクリーニングすることが可能です。 参考文献
お問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
© 2026 Cytiva