|
||
|---|---|---|
|
|
||
|
Location:Home > テクニカル情報配信サービス > Pharma Mail |
||
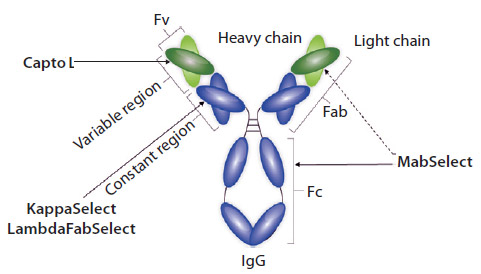
フラグメント抗体(Antibody Fragments)精製のプラットフォームアプローチFab、scFv、DAb等のフラグメント抗体は、モノクローナル抗体(MAb)などのタンパク質ベースのバイオ医薬品の次の有効候補として注目されています。フラグメント抗体は、その構造や小さなサイズにより、細胞へ浸透しやすいなどの優れた特性をもっています。
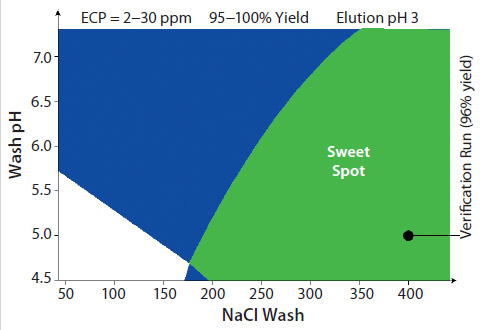
Capto™ Lを使用した3ステップのFab精製工程ここでは、大腸菌培養上清由来のカッパー・サブクラスFabの、Capto™ Lを使用した精製プロセス例を紹介します。このFabの理論的な等電点(pI)は8.5で、分子量は48 kDaです。開発時間を最小にするため、この3ステップの検討は一般的なワークフローに従いました。最初に、96ウェルプレートフォーマットのPreDictor™を使用して様々な担体のスクリーニングを行い、洗浄および溶出の条件を検討しました。2番目に、結合容量の検討は小さなカラムを使用し、精製したタンパク質を用いて結合ステップのみで行いました。3番目に、溶出pHの検討を行い最終的な溶出pHを決定しました。これは、酸性pHに敏感な一部のフラグメント抗体には重要です。各ステップの最適条件は、実験計画法(Design of Experiments, DoE)を用いて見出しました。このDoEを用いた一般的なアプローチは、クオリティー・バイ・デザイン(Quality by Design,QbD)もサポートし、96ウェルプレートを使用した検討ではcharacterized space(材料特性スペース)を示し、また、カラムを用いたDoEではデザイン・スペースと管理スペース(Control space)を示しました。 キャプチャーステップにおけるCapto™ Lの動的結合容量(Dynamic binding capacity)は、4分間のレジデンスタイム(接触時間)で21 mg/mlでした。pH 6から2.5へのpHグラジエントを用いた場合、このFabの溶出pHは3.2でした。以降のスクリーニング実験には、3水準実験計画法(three-factor DoE)を使用しました。検討した因子は、洗浄溶液のpH、洗浄溶液のNaCl濃度と溶出pHです。この検討におけるもっとも重要なレスポンスは大腸菌由来タンパク質(E.coli proyein, ECP)含有量とFabの回収率です。ECP含有量とFabの回収率のデータから全体の最適条件を見出すには、スイートスポット分析(sweetspot analyses)を用いることができます。 図2にはECP含有量2~30 ppmとFabの回収率95~100%のクライテリアに関するスイートスポット分析の結果を示しています。緑色の領域は上の2つのクライテリアを満たす領域です。この洗浄ステップの検証の試験をpH5および400 mM NaClの条件で行いました。この結果、期待通りにFabの回収率96%、ECP含有量は12 ppmと低い値となりました。
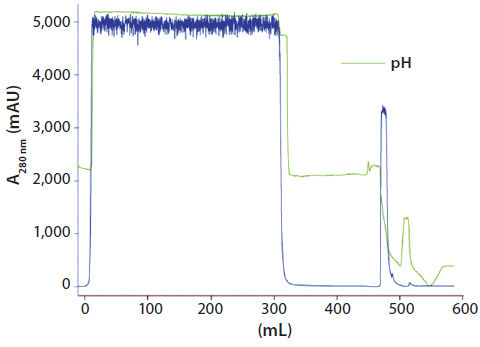
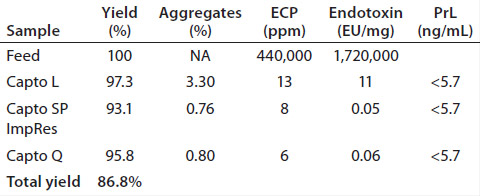
第2ステップの精製ステップには、Fabの重合体(aggregates)とモノマーを効率よく分離する目的で、Capto™ SP ImpRes(高い分離能を有する陽イオン交換担体)を選択しました。DoEにより、pH、NaClのグラジエントの長さおよびサンプルのロード(Load)について検討しました。洗浄時間や最終NaCl濃度などの一部の因子は一定にしました。続くモノマーの回収率と重合体の減少のスイートスッポト分析では、回収率>90%、および重合体≦1%の両方のクライテリアを満たす広い実験スペースが示されました。 第3ステップの検討では、陰イオン交換担体としてCapto™ Q、マルチモーダル陰イオン交換体としてCapto™ adhereの2種類の担体についてプレートを用いて評価しました。陰イオン交換体は不純物の減少の目的に使用されます。Capto™ QとCapto™ adhereはFabのように等電点の高いタンパク質の素通りモード精製に優れています。96ウェルプレートによるスクリーニングの結果、重合体の除去が不必要なためCapto™ Qを選択しました。等電点が8.5以下の場合には、pH8以下の条件でFabを素通モードで分画します。 この3ステップを最適化し、それぞれのステップにおけるほとんどの重要因子の効果を掌握したうえで、プロセスの検証を行いました。図3には、Capto™ Lを用いたキャプチャーステップを、得られた実験条件で行った場合のクロマトグラフィーを示しています。Fabはほとんど1カラム・ボリューム(CV)で溶出され、溶出のpHはおよそ4でした。3ステップの検証実験の結果を表1に示しました。
結論市場の動向から、今後、フラグメント抗体治療薬の開発が活発に行われることが予想されています。Cytivaではフラグメント抗体の精製プラットフォーム・アプローチを可能にするCapto™ Lと他の担体の開発を行いました。ここで紹介したキャプチャーステップにCapto™ Lを使用したFab精製の結果、全プロセスを通して、主要な不純物の効率的な除去と87%のFabの回収率が示されました。 文献
お問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
||
© 2025 Cytiva