|
||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
||||||||||||||||||||||
|
Location:Home > テクニカル情報配信サービス > Pharma Mail |
||||||||||||||||||||||
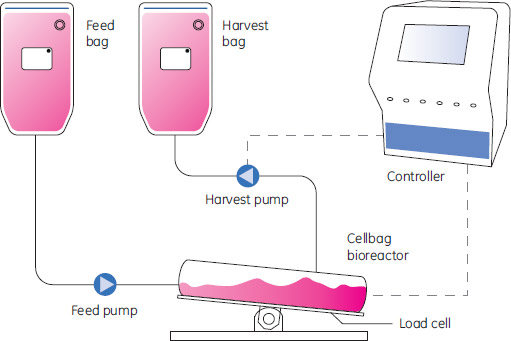
WAVE Bioreactor™システムを使用した播種および増殖効率の高いパーフュージョン培養パーフュージョン培養をベースとしたプロセスの開発は、スケールアップの比率を劇的に大きくしてきました。Fedバッチ細胞培養は、バッチあるいはパーフュージョン培養で播種して培養しました。全ての培養はWAVE Bioreactor™システムのディスポーサブルなCellbag™バイオリアクターで行いました。バッチ培養では最終細胞濃度が5.1 × 106 cells/mlであるにも関わらず、パーフュージョン培養では細胞密度は4.8 × 107 cells/mlに達しました。この高い細胞密度は、パーフュージョン培養で6倍スケールアップから30倍スケールアップまで拡大比率を上げることができました。ここで述べている方法は、培養の拡大ステップ数を少なくし、シードトレインにおいて1個か2個のバイオリアクターを削除できることを示しています。ディスポーサブル中の数Lの培養液が1000 Lまでのボリュームまでの直接の播種に使用できる可能性があります。パーフュージョン培養による高い生産物濃度は細胞密度を増加させるシード培養にも使用できます。このことは、時としてプラントにおける生産性のボトルネックとなる、これらのバイオリアクターのプロセス時間を短縮することに寄与します。 はじめに動物細胞の播種は、シード培養で得られた十分な細胞数が得られるまで、培養ボリュームを増加させた一連のバッチ培養で行います。これらの種培養において達成される最大細胞密度は、次の培養への拡大比率を制限し、シードトレインにおいて数個のバイオリアクターの使用が必要となります。一般的に連続する拡大比率は1:5か1:10です。パーフュージョン培養の場合、非常に高い細胞密度が得られます。そのため、高い倍率で希釈でき、拡大ステップ数の減少に寄与します。 ディスポーサブルバイオリアクターはフレキシブル性の高さ、ターン・オーバー時間の短さ、洗浄や殺菌の削減といった利点から、細胞培養によく使用されるようになりました。CHO, HEK, NS0, S2 およびSF9などの多くの動物細胞株でWAVE Bioreactor™システムでの培養が成功し、このシステムのフレキシブル性が示されています(1-5)。 この研究では、パーフュージョン培養の全自動コントロールを組み込んだシングルユースのWAVE Bioreactor™で拡大培養を行いました。リアクターの概略は図1に示しました。細胞はあらかじめ滅菌し、膨らませた培養チャンバーであるCellbag™バイオリアクターで培養しました。震盪トレーに置いたバッグを震盪する事によって混合しました。トレー下のヒーターパッドを介して加熱、ガスは外気と二酸化炭素の混合気を満たした上部空間から供給し、高い濃度の酸素を混合しました。溶存酸素(DO)濃度とpHをリアクターに組み込んだプローブを用いて測定しました。パラメーターはWAVE™POD IIプロセスコントロールユニットで制御しました。パーフュージョンモードではポアサイズ7 μmのフィルターを培養液表面に浮かべたリアクター内で培養しました。混合はフィルターの横方向の動きにより起こり、細胞の接着を遅らせ、フィルターのライフタイムを長くします。Feedとハーベストの添加・回収を定期的に等量ずつ行うことができるロードセルがシステムに統合されており、これを用いてパーフュージョンの比率を制御しました。パーフュージョン培養は図1に示しました。フィルターを介した細胞保持は外部のリサイクル・ループを必要とせず、あらかじめ設定した1~25 LのCellbag™バイオリアクターを使用できます。
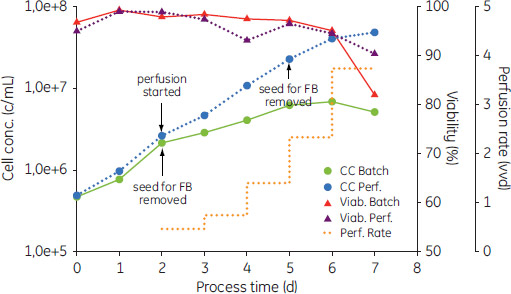
材料と方法細胞株と培地この研究ではCHO-S™細胞(ライフテクノロジーズ社)を使用しました。細胞は無血清培地(T13, Shanghai Hankang Biotech Co.)で培養しました。フェド-バッチ培養では同じメーカーの栄養塩濃縮物(T13-F)を使用しました。 バイオリアクターでの培養全ての培養はWAVE Bioreactor™ 20/50 system EHTで行いました。バッチとフェド-バッチ培養は10 LのCellbag™で4 Lの培養液を入れて行いました。パーフュージョン培養は2 LのCellbag™に1 Lの培地を入れて行いました。培養条件はWAVE™POD II controllerで制御しました。pHは7.10、DOは40%飽和にセットしました。酸素供給は0.2 L/分(Lpm)の流速で供給した外気を上部空間でエアレーションし行いました。混合は全ての培養で、25 rpm、6°で行いました。 培養は毎日細胞数をカウントし、バイアビリティーはトリパンブルー排除法を利用し血球計で測定しました。これに加え、グルコースと乳酸濃度は酵素を使用した生物学的分析方法で測定しました(SBA-40C, Shandong Academy of Sciences, China)。グルコース残存濃度が0.5 g/L以上になるように、フィードの添加量やパーフュージョンの割合を調節しました。フェド培養やパーフュージョン培養の播種は、最大の成長率を維持している対数成長期の最後に行いました。両方の培養は細胞増殖が行われ、最大の密度になるまで行いました。パーフュージョン培養では1日あたり1.5倍培養液量の培地を交換し、それに続くフェド-バッチ培養に播種しました。それに続く2日の間、培養を終了するまで、パーフュージョン培養は1日あたり最大3.7培養液量まで増加しました。 フェド培養とパーフュージョン培養からそれに続くフェド-バッチ培養はバイアビリティーが60%の時点で終了しました。 結果と考察播種と増殖バッチあるいはパーフュージョン培養でCHO-S™細胞を培養し、フェド-バッチ培養に播種しました。初期フェーズでは、両方の細胞成長は同程度でした(図2)。しかし、高いバイアビリティーにもかかわらず、培養開始2日間の0.8 × d-1から、6日目までに0.3 × d-1に減少しました。パーフュージョン培養における培地の交換は、2日目からスタートしました。細胞播種は細胞が最大増殖をして95%以上のバイアビリティーを持つ間に行いました。
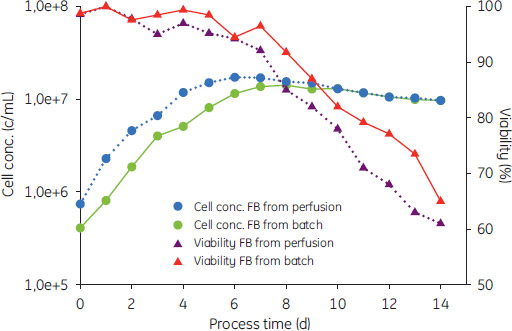
フェド-バッチ培養パーフュージョン培養で得られた高い密度の細胞を、それに続くフェド-バッチ培養用に播種しました。バッチ培養で使用される1:5の比率より高い1:30比率としました。それに続く2種類のフェド-バッチ培養における細胞の増殖を図3に示します。バッチ培養あるいはパーフュージョン培養から播種された培養の増殖率は5日間まで0.6 × d-1で変わりませんでした。播種後には誘導期は見られませんでした。最大の細胞密度は、パーフュージョン培養からフェド-バッチ培養の6日目、1.73 × 107細胞/mlで、また、バッチ培養からフェド-バッチ培養では8日目の1.42 × 107細胞/mLでした。相違はパーフュージョン培養からのより高い播種細胞密度で説明することができます。 バッチモードからの播種では、拡大比率1:5の培養を追加で2回行わないと高い比率を得られなかったのに比べて、パーフュージョン培養からの播種では比率が高く、少なくとも1回培養を省くことができています。増殖率が0.8 × d-1から0.6 × d-1に低下することを許容できる場合、、さらに高い比率も実現できます。この段階では細胞は対数増殖期ではありませんが、培養6日目で細胞密度は4.06 × 107個/mlでバイアビリティーは96%でした。細胞密度4 × 105個/mlで播種比率は1:100.で行いました。図3では播種の細胞濃度を80%増加させることで、最大細胞濃度に到達するまでに2日間早くなったことを示しています。それに加え、細胞のバイアビリティーが20%増加しました(データ表示なし)。生産物が同じレベルまで2日早く到達したので、細胞増殖の間の製品の生産が一定と仮定すれば、バイオリアクターでの培養を2日間短縮できることを示しています。
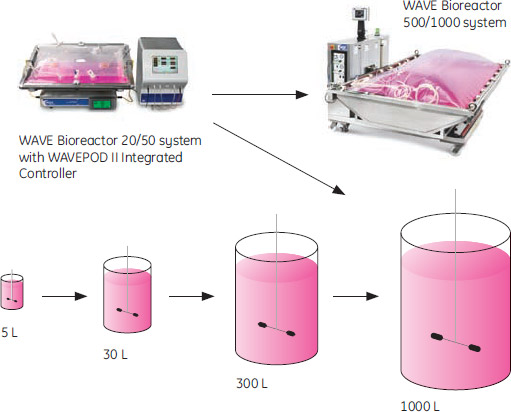
まとめパーフュージョン培養からの播種は、従来のバッチ培養に比較して、少なくとも5倍から10倍高い播種割合で行うことができました。これにより、シードトレインのステップの数を減らすことができ、その結果、バイオリアクターのコストを下げることができます。シングルユースバイオリアクターはターンオーバー時間を減少させ、プロセスのフレキシブル性を高めます。 パーフュージョン培養モードの場合、リアクターに直接播種して1000 Lまでの培養が可能です。バッチ培養とパーフュージョン培養のシードトレインの添加の例を図4に示しました。さらに、パーフュージョン培養は高い密度のシードを生産リアクターに供給し、リアクターのプロセス時間短縮化と設備のスループット改善にも貢献できます。
参考文献
お問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
||||||||||||||||||||||
© 2025 Cytiva