タグ付きタンパク質を用いたタンパク質相互作用解析
~Pull-down assay(プルダウンアッセイ)を中心に~
相互作用タンパク質の特定は、機能未知のタンパク質の働きを知る上で非常に重要な情報です。ここでは、タグ付きタンパク質を利用した相互解析手法について紹介します。主にGST融合タンパク質を用いたプルダウンアッセイを中心に、相互作用解析の手法を見ていきましょう。
タグ付きタンパク質が相互作用解析に
相互作用タンパク質の解析にタグ付きタンパク質が有用である理由として、以下の事項が挙げられます。
純度を高めることが容易
タグ付きタンパク質はアフィニティー精製により、純度の高い目的タンパク質を容易に得ることができます。
タグを利用した特異的結合・検出が可能
目的タンパク質の抗体が手元に無い場合にも、タグに対する抗体、もしくは特異的に作用する分子を用いて結合・検出することができます。下記に掲載しているプルダウンアッセイでは担体への結合、ファーウェスタンブロッティングでは検出にこの特長を利用しています。
これらの特性からタグ付きタンパク質は相互作用解析に広く用いられています。本報では、下記3種の相互作用解析手法についてご紹介します。
Pull-down assay (プルダウンアッセイ)
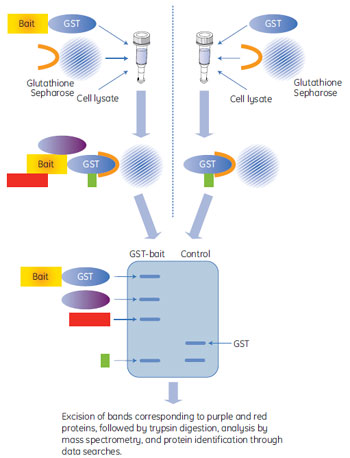
図1 GST融合タンパク質を利用したPull-down assay 実験の流れ
左:GST-bait (解析対象タンパク質), 右:GSTのみ (コントロール)
図例の場合、GST融合ベイトタンパク質に結合するタンパク質3種類(赤、紫、緑)確認されています。緑で示されるタンパク質はコントロール(GST)にも確認されているため、疑陽性の相互作用タンパク質と判断されます。
プルダウンアッセイは、タグ付きタンパク質を使った相互作用タンパク質解析で最も一般的な方法です。担体に固定化したタグ付きタンパク質(ベイト)に任意のサンプルをインキュベートした後に溶出させ、ベイトと相互作用する(結合する)タンパク質との複合体を単離する方法です。インキュベートするサンプル溶液には、細胞抽出液や培養上清、またはベイトとの相互作用が予想される精製タンパク質などを用います。
GST融合タンパク質を用いたプルダウンアッセイの実験フローを図1に示しました。プルダウンアッセイをはじめとした相互作用タンパク質解析では、いかに疑陽性タンパク質*を除くかがポイントです。GST融合タンパク質を用いたプルダウンアッセイにおける注意点を以下に挙げておきます。
(* 疑陽性タンパク質:実験ではベイトと共に単離されるが、生体内ではベイトと相互作用していないタンパク質)
コントロールサンプルの使用
図右のフローはGSTのみを用いたコントロールの解析系を示しており、ここで溶出されたタンパク質は疑陽性として扱います。
処理する前のサンプルをあらかじめ担体で処理することも効果があります。たとえば、GST SpinTrap™にはGlutathione Sepharose™ 4Bが担体として用いられているため、 一度Sepharose™ 4Bにサンプルをインキュベートさせる操作を挟むことで、担体が要因となる疑陽性タンパク質を除去することができます。
ベイトタンパク質の精製純度
当然のことですが、不純物は疑陽性結合のタンパク質が増える要因となります。アフィニティー精製だけでは純度が不十分である場合には、イオン交換クロマトグラフィーやゲルろ過クロマトグラフィーなどで純度を十分に高めます。
大腸菌でGST融合タンパク質を発現させた際には、いくつかの大腸菌由来タンパク質が担体に結合することが報告されています。これら代表的な不純物の除去方法については、下記リンク先をご参照ください。
使用するタグの検討
GSTはある程度の大きさ(Mr = 26,000 )をもちますので、相互作用の特性によっては結合が阻害される可能性があります。このケースでは、タグの位置をN末端、またはC末端に入れ替えることで改善される可能性があります。
N末端、C末端を入れ替えても改善しない場合では、タグ自体を変えてしまいましょう。His-tag、Strep(II)-tag、Flag-tagなどの低分子タグであれば、立体的な相互作用障害はおきにくくなります。
インキュベート時間の検討
インキュベートの時間が長すぎると、疑陽性のタンパク質が結合しやすくなります。下記、一般プロトコールの4℃、2時間が標準的ですが、解析対象によってはインキュベート時間を最適化することで信頼性の高い結果を得ることができます。
プルダウンアッセイのプロトコール例
プルダウンアッセイの一般プロトコールをご紹介します。ここでは、スピンカラムタイプのGlutathion担体であるGST SpinTrap™を用いた例を挙げます。
プルダウンアッセイのプロトコール例
細胞抽出液を用いる場合、一般的に10の6乗~7乗の細胞でサンプル調製を行います。サンプル量については、実験結果を解析後に調節してください。
- スピンカラム内の担体(Glutathione Sepharose™ 4B)をボルテックスして再懸濁する。
- カラムのキャップを1/4程度空け、カラム底の封をとる。封は保存しておく。
- カラムを1.5 mlチューブに設置し、735×g、 1 min 遠心分離する。
- チューブに落ちたバッファーは捨て、カラムの底に封をはめる。
- GST融合ベイトタンパク質を含むサンプル溶液(最大600 µl )を添加する。同様に、コントロールとしてGSTにサンプル溶液を処理したものも用意する。
- 上部のキャップを閉めてからデカンテーションで混合させ、4℃で2時間インキュベートする。
- 上部のキャップとカラム底の封を外し、カラムを1.5 mlチューブに設置する。(区別できるようにチューブはラベルしておく)
- 735×g、 1 min 遠心分離する。素通り溶液は保存しておき、必要に応じてSDS-PAGEで検証する。
- カラムを新しい1.5 mlチューブに設置後、600 µlのPBSをカラムに添加し、735×g、. 1 min 遠心分離する。 ※必要に応じてこの洗浄操作を数回くり返す
- 100~200 µl の溶出バッファーをカラムに添加し、キャップと封をして5~10分インキュベートする。 ※結果が芳しくない場合にはインキュベート時間やグルタチオン濃度を調製する
- 上部のキャップとカラム底の封を外し、カラムを1.5 mlチューブに設置する。(区別できるようにチューブはラベルしておく)
- 735×g、 1 min 遠心分離し、溶出サンプルとする。
ファーウェスタンブロッティング (ウエストウエスタンブロッティング)
ファーウェスタンブロッティングは、メンブレンに転写したタンパク質との相互作用を解析する手法です。ウエストウエスタンブロッティングとも呼ばれています。
図2に実験フローを示しました。SDS-PAGE、または二次元電気泳動で展開したサンプルをメンブレンに転写したのち(図2, A)、精製したベイトタンパク質溶液を作用させます。相互作用タンパク質のバンド or スポットにはベイトが結合するため(図2, B)、ベイトを特異的に検出する(図2, C)ことで相互作用タンパク質のバンド or スポットを特定する手法です。
精製のしやすさを考えると、タグ付きタンパク質をベイトとして用いる方法はとても有用です。GST融合タンパク質の場合、抗GST抗体がありますので、ベイトそのものの抗体が無くとも抗体検出することができます。対して、His-tag に対しては特異性の高い抗体がないため、この検出法にはあまり向いていません。
ベイトをRI 標識、または蛍光標識する手法もあります。この場合でも、精製の時点ではタグ付きタンパク質として発現させていることが多いようです。
図2 GST融合タンパク質を利用したファーウェスタンブロッティングの実験の流れ
- 細胞抽出液を二次元電気泳動で展開し、メンブレンに転写する。(A)
- メンブレン上に転写されたタンパク質の変性/リフォールディング処理を行う*
- ブロッキング処理を行う。
- ベイトタンパク質溶液とインキュベートする。(B)
- 洗浄操作後、抗GST抗体とインキュベートする。(C, 左)
- ECL™による化学発光など、任意の検出法で検出する。(C, 右)
 :GST融合ベイトタンパク質
:GST融合ベイトタンパク質  :抗GST抗体
:抗GST抗体
* 変性/リフォールディング処理は、6 Mグアニジン塩酸を含むTBSTなどの希釈溶液により変性処理を行ったのち、グアニジン塩酸濃度を2倍希釈していく方法が一般的です。それぞれの処理時間はプロトコールにより様々ですが、5~20分程度です。
Biacore™
Biacore™による解析では結合をリアルタイムで観察できるため、得られる情報は単なる結合タンパク質の同定にはとどまりません。結合の強さ、特異性、カイネティクス(結合の速度論的な解析)など多くの有用な情報を得ることができます。たとえば、上記手法では特定が難しい弱い相互作用をもつタンパク質の単離も可能となります。上記の手法で特定された相互作用タンパク質との関連を、深く解析することにも役立ちます。
抗体を用いることでGST融合タンパク質を結合させたセンサーチップも簡単に用意できます。
関連情報
●TAP法を用いたタンパク質複合体単離例
TAP法(tandem affinity purification:タンデムアフィニティー精製)は、2種類のアフィニティータグを用いて精製純度を高める方法です。TAP法を用いたSchizosaccharomyces pombe 由来のタンパク質複合体解析例です。
●製品・技術情報

