
|
||
|---|---|---|
|
|
||
|
Location:Home > テクニカル情報配信サービス > Pure Protein Club |
||
Kvick™ labカセットを用いたCHO細胞培養液の濃縮10 kD Kvick™ labカセットを用い、CHO細胞培養液のクロスフローろ過プロセスを開発、至適化を行いました。サンプルの濃縮およびダイアフィルトレーションを2種類のクロスフロー流量で至適化し、1,500 Lのバッチサイズまでスケールアップしました。併せて、このプロセスにおける効果的な洗浄方法についても実証しました。この結果、TMP(transmembrane pressure) 2.2 bar、クロスフロー流量 8.2 l/min/m2が推奨のプロセス条件でした。 はじめにCHO細胞はモノクローナル抗体ほか、治療用タンパク質生産の発現系に幅広く利用されている細胞です。CHO細胞培養液の濃縮には、高流束で処理できるフラットシートカセットが適しています。 メンブレンの公称分画分子量(NMWC)はプロセスの性能に大きく関係します。 実験と結果TMPの至適化TMPは流束に直接影響をおよぼすため、TMPの至適化は重要です。TMPが低いと、流束が落ち、大きなメンブレン面積が必要となるため、さらに大型のシステムが必要となります。一方、TMPが高すぎると、ゲル層の形成が進みます。最適なTMPは、あるクロスフロー流量におけるTMP-流束曲線で求めることができます。 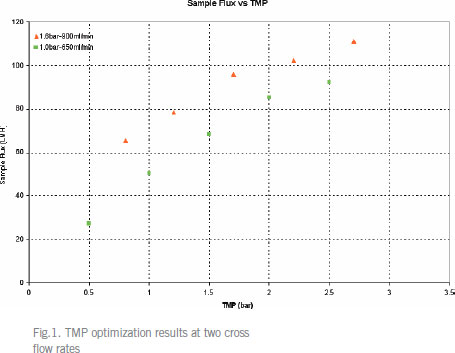 20倍濃縮におけるプロセススケーラビリティー実験TMP至適化実験で選択した(1)TMP 2.2 bar、クロスフロー流量 900 ml/min、(2)TMP 1.5 bar、クロスフロー流量 650 ml/minの 2種類のプロセス条件にて、プロセススケーラビリティーを検討しました。それぞれ20 LのCHO細胞培養液を用い、20倍濃縮および5倍量のダイアフィルトレーションを行いました。Fig.2にサンプル流束-ろ過量曲線を示します。サンプル流束-濃縮倍率曲線の結果は、Fig.3に示します。 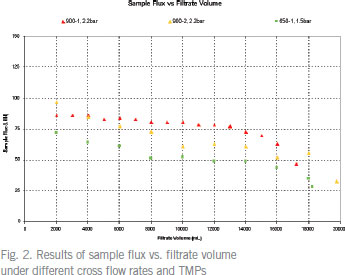 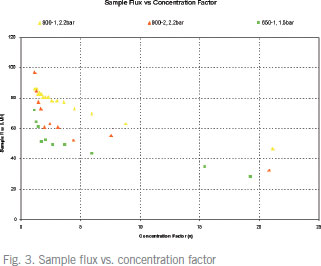 カセット洗浄方法の評価標準的なカセットの水流束テストを用い、3種類のカセット洗浄方法を評価しました。低下してしまった流束を回復させるため、Table 1のカセット洗浄プロトコールにて検討を行いました。室温にて0.5 M NaOHで30分、40℃において1 M NaOHで洗浄、また室温にて次亜塩素酸ナトリウムを含む0.5 M NaOH (300 ppm)の3種類の洗浄方法を検討しました。NaOHと次亜塩素酸ナトリウムの組合せが最も効果的でした(Table 1)。 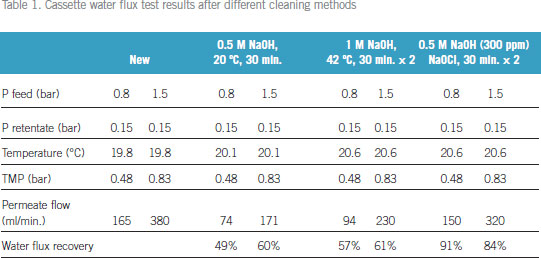 プロセス安定性の検討NaOH-NaOClの洗浄プロトコールが本当に効果的であったかを検証するために、3回目のクロスフロー流量900 ml/min、TMP 2.2 barでのCHO細胞培養液の濃縮試験を実施しました。その結果、サンプル流束と濃縮倍率より、最初の処理とほぼ同じ結果が得られました(Fig.4)。 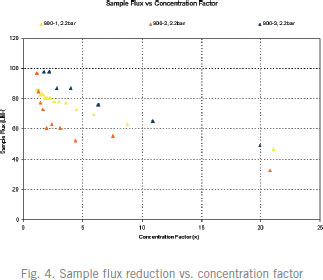 ダイアフィルトレーションの至適化バッファー消費量とプロセス時間の両方で、ダイアフィルトレーションを至適化しました。濃縮倍率ごとのサンプル流束にて評価しました(Fig. 5)。ダイアフィルトレーション至適化曲線は、クロスフロー流量に対しプロットしました。最速なプロセス時間で処理するためのダイアフィルトレーション条件は、このデータから得ることができます。 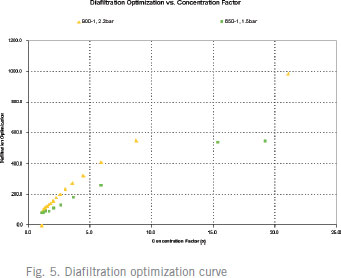 プロセスのスケールアップKvick™ labカセットはKvick™ flowカセット(Cytiva)へ直線的にスケールアップが可能です。至適化されたプロセス条件にて、1,500 Lまでスケールアップし、5時間で処理できました。 Kvick™ lab(Table 2)で得られた結果をもとに、異なるプロセス条件におけるサンプル流束の平均を計算しました。1,500 Lバッチに必要なメンブレン面積を計算し、Table 2に結果を示しました。5時間で処理を完了するためには、クロスフロー流量 900 ml/minの結果を用いて計算した結果、メンブレン面積は4.5 m2、一方クロスフロー流量 650 ml/minの結果を用いた場合は、メンブレン面積は5.9 m2が必要であるという結果がでました。4.5 m2のシステムに要求されるクロスフロー流量は37 l/min、5.9 m2では35 l/minです。 Kvick™ labテストで得られた結果をもとにスケールアップの計算を行ったところ、クロスフロー流量 8.2 l/m2/min、TMP 2.2 barでの運転が推奨されました。 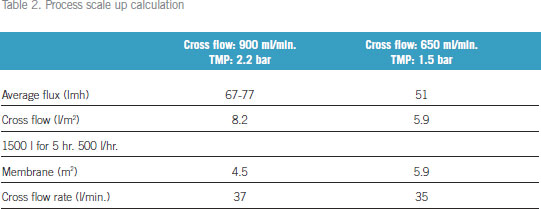 まとめこの研究では、目的タンパク質の分子量が約37 kDであったため、10 kDカセットを選択しました。 お問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
||
© 2026 Cytiva
