DeltaVision Eliteのライブ観察で明らかになった、オートファゴソームの成熟過程
DeltaVision Eliteお客さまの声

東京大学 医学部・大学院医学系研究科
分子生物学分野 水島研究室
本田 郁子様
DeltaVisionのライブ観察で明らかになった、オートファゴソームの成熟過程
最近Science誌に掲載された、オートファゴソームの成熟過程についての発見(※)について、DeltaVision Eliteがお役に立てた点などについてお伺いました。
オートファゴソームの形成過程をライブで追う
本田先生のご研究で注目しているオートファゴソームの形成過程についてお聞かせください。
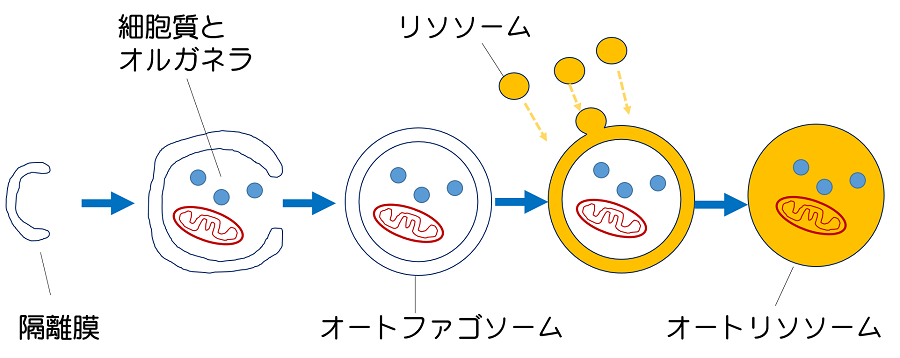
私たちの観察するオートファゴソームの形成過程は、1個の点状構造として見え始めてから直径約1 μmの球体のオートファゴソームが完成するまで、およそ10分の過程です。諸説ありますが、小胞体の特殊な領域から隔離膜とよばれる扁平な袋状の膜構造が形成され、それが伸長しながら細胞質やオルガネラを取り込み、最後に袋が閉じて外膜と内膜をもつ2重の構造のオートファゴソームが形成されると考えられています。
その後、オートファゴソーム外膜にリソソームが融合することで、リソソーム内の消化酵素が流入して内容物が分解され、オートリソソームへと成熟します(オートファジー)。
このダイナミックなオートファゴソームの形成と成熟の過程を生きたままで光学顕微鏡を用いて観察しています。
図:オートファジーのプロセス
ライブでのオートファゴソームの観察を実現するうえで課題はありますか?
オートファゴソーム形成にかかわるATGタンパク質群のほとんどは、膜タンパク質ではなく主に細胞質タンパク質です。オートファゴソーム膜には細胞質に対して1.2~2倍の濃度にしか局在しません。すなわちATGタンパク質のオートファゴソーム局在像はS/N比が非常に低いのが問題です。そしてこの弱いシグナルをタイムラプスで数百枚も撮影すると、蛍光褪色が大きな問題になります。これらの問題を克服できる顕微鏡技術が必要でした。
DeltaVision Eliteをオートファゴソームライブ観察に選んだ理由は?
そのオートファゴソームの形成過程の観察に、弊社高解像度顕微鏡DeltaVision Eliteをお使いとのことですが、お選びいただいた理由をお聞かせください。
DeltaVision Eliteをデモ使用させていただいた際、個々のオートファゴソーム構造を非常にコントラストの高いリング状パターンとして検出できたため、導入をさせていただきました。理由を考えてみると、DeltaVision Eliteはレンズをはじめパーツが1つ1つ丁寧に選ばれていて、システム全体として感度が高い顕微鏡になっているため、オートファゴソームがコントラストよく見えているのだと思います。
また、私たちがオートファゴソームの形成過程をタイムラプス観察するときはたいてい10秒から30秒間隔で、30分から1時間の撮影をします。Deconvolution処理をする場合は、3枚ずつZセクションを撮ります。するとトータルの撮影枚数が100枚を軽く超えることになります。
DeltaVision Eliteの半導体光源は細胞に優しく、100枚以上の撮影に細胞が耐えながら、十分なシグナルが撮れています。この点は製品評価目的のデモではわからなかったことで、実際に導入してみて実感しました。
DeltaVision Eliteでの観察がきっかけで新しい発見に
最近Science誌で発表された発見についてDeltaVision Eliteがお役に立てた点をお聞かせください。
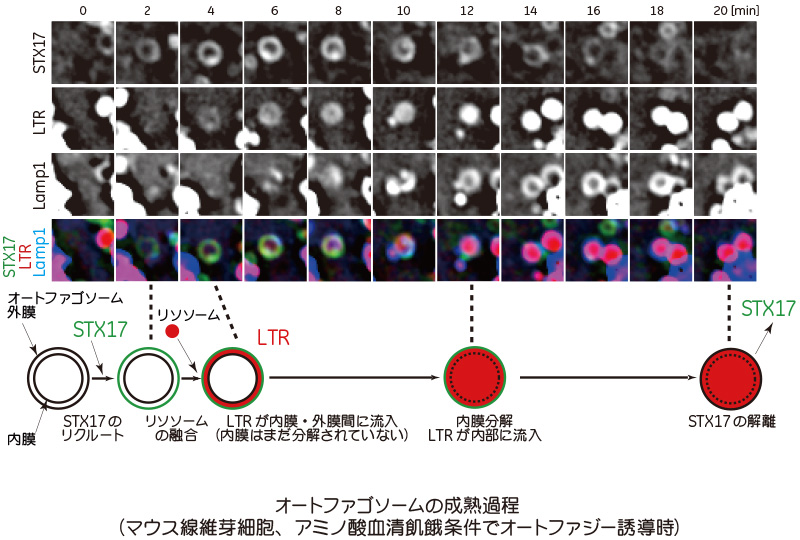
DeltaVision Eliteが役に立った点は、オートファゴソームの外膜と内膜の間にLysoTracker Red (LTR)の局在をとらえられたことです。これまでは、リソソームがオートファゴソームの外膜と融合した瞬間に内膜と共に取り囲んだ内容物が分解されるだろうと予想していましたが、実際ライブで観察できた例はありませんでした。
GFP-Syntaxin17(STX17)をオートファゴソームマーカーとして、LTRを酸性領域マーカーとして、DeltaVision Eliteでタイムラプス撮影したところ、STX17陽性構造がLTR陽性に変化したとき、とても弱いシグナルですがそれがリング状パターンであることに気付きました。これは、リソソームがオートファゴソーム外膜と融合し、内膜と外膜の間の領域に酸性リソソーム酵素が流入したが、内膜はまだ分解されていない状態を意味します。
LTRシグナルのリング状パターンは約7分間観察され、その後、均一のパターンに変化しました。すなわち、このときようやく内膜が分解されリソソームの酸性酵素がオートファゴソーム内部に流入したことを示しています。このように、オートファゴソームがオートリソソームに成熟する過程において、リソソームの融合と内膜分解という2つのステップに分けて検出できたことが、今回の大きな発見の1つでした。
この観察は、共同研究者の坪山幸太郎さん(当時東大医学部5年生)の素晴らしい観察眼と豊かな想像力によるところが大きいのですが、それに加えて、DeltaVision Eliteで弱いシグナルをコントラスト良く検出できたことが大変役に立ちました。さきほども申しましたように、DeltaVision Eliteは構成部品が一つ一つ丁寧に選ばれている顕微鏡のため、結果的にシステム全体の感度がよくなり、弱いシグナルを観察できたのではないかと考えています。その後、ラボにある共焦点顕微鏡でも設定を最適化することでLTRのリング状の局在を観察でき、裏打ちのデータになりました。
図:DeltaVision Eliteの撮影画像
ライブセルイメージングのコツ
ライブセルイメージングで大事なことは何でしょうか?
経験が少ないと、ライブイメージングは難しそうな印象がありますよね。最初は経験者と一緒に何度か練習するとよいかと思います。操作自体はすぐに慣れますが、撮影パラメータの最適化作業については戸惑うところかと思います。
ライブイメージングのためのパラメータは、蛍光の選定、励起光強度、露光時間、タイムラプス間隔、トータル撮影時間などがあり、これらの組み合わせで幾通りもの条件が考えられます。用意された条件をとりあえずやってみるだけではなく、それぞれ目的の撮影のための最適条件を決めることが重要です。
そのためには、まず、どういう現象を観たいのかをよく頭にイメージすることが大事です。イメージングをする前に頭の中でイメージするというのは、逆説的ではありますが。とりあえずライブイメージングを撮ってみるという態度では、良い条件での観察はできません。
どんな実験でもそうですが、仮説をしっかり立てたうえで観察に臨むことが必須かと思います。見たい現象は1秒で終わる現象なのか1分で終わる現象なのか。観察時間中に起こる「変化」をとらえたいわけですから、どれくらいの間隔で撮れば変化の過程を見逃さないか。また、光毒性や褪色のためトータルの撮影枚数と露光強度には限りがありますから、その制限の中で、最小のS/N像で枚数をたくさん稼ぐことが必要か、あるいはS/N重視で少ない枚数でよいのか。というように、見たい現象をしっかりと意識しながら各パラメータを吟味して、トライアルアンドエラーを繰り返して条件を最適化します。
このプロセスが、ライブイメージングの敷居をやや高くしているのかもしれません。ですが、敷居を高くしている原因はライブセルイメージングの技術的な難しさではなく、実験のための仮説をしっかり立てるところなのだと思います。
ほかの顕微鏡との使い分け
ほかにも最新の技術の顕微鏡をお持ちだとお伺いしていますが、どう使い分けていますか?
冷却高感度GaAsP外部検出器を設置した走査型の共焦点顕微鏡と、スピニングディスク(ニポーディスク)式共焦点顕微鏡を保有しております。
FRAPのようなレーザー走査が必要な実験にはもちろん走査型共焦点顕微鏡を使用します。また、固定細胞染色試料で複数因子の共局在を調べるとき、マウス組織切片やゼブラフィッシュのような厚みのあるサンプルのときは、走査型共焦点顕微鏡で撮影します。
スピニングディスク式共焦点は小胞体(ER)のメッシュ構造をコントラスト高くライブ観察したい時によく使用しています。小胞体のような三次元に混雑した構造は、やはり光学切片が向いているようです。
しかし、光学切片にするとどうしてもシグナル量が減るため、シグナルが少ないオートファゴソームのような構造を詳細に撮りたい場合は、DeltaVision EliteでWide Fieldの十分なシグナルを得てからDeconvolution 処理するのがよさそうです。
これが現時点での大まかな使い分けです。技術は驚くほど早く進歩するので、5年後には使い分け方がすっかり変わっているかもしれませんね。
今後のイメージングの世界への期待
最後に今後の課題や技術への期待などについてお聞かせください。
- よりよい蛍光ラベル手法の発展:新しい蛍光ラベル(蛍光色素や蛍光タンパク質)によりこれまで諦めていた観察が可能になります。より明るく褪色に強い蛍光ラベル素材の開発を期待しています。
- 情報処理技術:今後は3Dで細胞まるごとをタイムコースで撮りたいと思っています。画像取得に関してはすぐ実現できると思うのですが、画像情報処理については、ファイル容量だけでなく解釈すべき情報そのものが大量になります。これからは情報処理の専門家とのコラボレーションが重要になっていきそうです。人工知能を用いた画像認識にも興味を持っています。
お客さまの使用経験に基づく記載です。
本田様ご所属の東京大学 医学部・大学院医学系研究科分子生物学分野 水島研究室のご研究紹介
水島昇教授によって主宰される分子生物学分野では、オートファゴソームの形成にかかわるAtg遺伝子群の欠損モデルマウスや蛍光タンパク質を用いたライブセルイメージングなどの様々な技術を駆使して、オートファジーの生理的意義や制御メカニズム、ひいては病気、疾患とのかかわりまで幅広く分野をリードする研究を展開されています。
本田先生はDeltaVisionをライブセルイメージングのツールとして活用されつつ、オートファゴソームの形成過程の分子メカニズムを解明されています。
東京大学 医学部・大学院医学系研究科分子生物学分野 水島研究室
※ Kotaro Tsuboyama*, Ikuko Koyama-Honda* (*contributed equally), Yuriko Sakamaki, Masato Koike, Hideaki Morishita, and Noboru Mizushima. (2016) The ATG conjugation systems are important for degradation of the inner autophagosomal membrane. Science 354, 1036-1041

