
|
|||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
Location:Home > サポート・保守情報 > お客さまの声・データ紹介 |
|||||||||||||||||||||||||||||||||||||||||||||
お客さまレビュー/データ紹介 HisTrap™ HP その2His-tagタンパク質精製用カラム
高結合容量が特長のNi Sepharose™ High Performanceがパッキングされた、HiTrap™タイプのカラムです。シリンジ、システム操作に対応します。
|
|||||||||||||||||||||||||||||||||||||||||||||
| 名称 | NPAS-2 |
|---|---|
| 溶液・濃度 | 5 ml, 1 mg/ml |
| 発現系 | 大腸菌 |
[精製条件]
| 結合バッファー: | 50 mM Sodium phosphate, 50 mM NaCl, pH 7.8 |
|---|---|
| 溶出バッファー: | 50 mM Sodium phosphate, 50 mM NaCl, 100 mM Imidazole, pH 7.8 |
| 溶出条件 : | ステップワイズ(20%、50%) |
[使用システム]
ÄKTA™explorer 10S(流速:0.5 ml/min)
データ
【精製結果】: クロマトグラムはPDFファイルをご覧ください。
→ クロマトグラム(PDF:58KB)
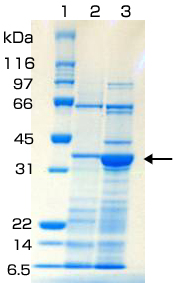
精製後のSDS-PAGE (12.5%ゲル、CBB染色)
- レーン1: Standard(プレステインドSDS-PAGEスタンダード、Broad(Bio-Rad))
- レーン2: HiTrap™ Chelating HPによる精製フラクション
- レーン3: HisTrap™ HPによる精製フラクション
結果についてのコメント
NPAS-2のPAS-AドメインをpET28に導入し、大腸菌 [BL21(DE3)CodonPlus RIL] にて発現させた。大腸菌をリゾチーム処理および超音波破砕して超遠心にて固形物を除去し、0.45 μmのフィルトレーション後にÄKTA™explorer 10Sを用いて精製した。2つのクロマトグラムは、10 mlの大腸菌破砕液を5 mlずつ(まったく同じ試料を同じ量)アプライしたものである。
B conc. 20 %および50 %の2つの濃度でタンパク質を溶出した。50 % Bの溶出が目的タンパク質であり、そこを回収した。fraction no.14-15の280 nm(青線)の吸収を2つのクロマトグラムで比べると、明らかにHisTrap™ HPの方が大きく、収量がよくなっているのがわかる(2倍以上)。このタンパク質には407 nm(赤線)付近にも補酵素由来の吸収があるので、この吸収が大きいほど、よりきれいに精製されたことになり、HisTrap™ HPの方が吸収が大きいことが確認できる。
SDS-PAGEの結果は、fraction no.14を1/2に濃縮し、5μl/wellアプライしてCBB染色したものである。目的タンパク質(矢印)の分子量は17 kDaである(ダイマー)。明らかにHisTrap™ HPの方が目的タンパク質の収量がよくなっているのがわかる。
先に、補酵素由来の吸収が407 nmにあり、この波長の吸収が大きいことが重要だ、と述べた。しかし、補酵素は強固にタンパク質に結合しているわけではなく、精製途中に解離している可能性がある。そのため、407 nmの吸収よりSDS-PAGEのバンドの太さで判断する方が、HisTrap™ HPおよびHiTrap™ Chelating HPの収量の差がはっきり現れていた。
東京慈恵会医科大学 生化学講座 第1
青木 勝彦 先生
HisTrap™ HPを使用した感想
- シリンジを使って手軽に精製できた。
- 精製の条件検討が容易にできた。
- 還元剤存在下で使用できるのはよい。
実験方法
[サンプル]
| 名称 | 出芽酵母NAP™-1を発現させた大腸菌抽出液 |
|---|---|
| 溶液・濃度 | 5 ml, 4 mg/ml |
| 添加剤 | PMSF(濃度:0.1 mM) |
| 発現系 | 大腸菌 |
[精製条件]
| 結合バッファー: | 20 mM Tris-HCl, 0.5 M NaCl, 40 mM Imidazole, pH 7.4 |
|---|---|
| 溶出バッファー: | 20 mM Tris-HCl, 0.5 M NaCl, 0.3 M Imidazole, pH 7.4 |
| 溶出条件: | ステップワイズ |
[精製方法]
シリンジを用いたマニュアル操作
結果
| 収量 | 収量:5.0 mg |
|---|---|
| 回収率 | 89% |
| 純度 | 90% |
データ
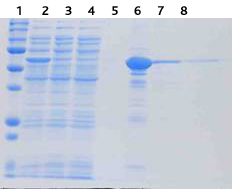
HisTrap™ HP精製後のSDS-PAGE (CBB染色)
- レーン1:分子量マーカー
- レーン2:input
- レーン3:非吸着画分1
- レーン4:非吸着画分2
- レーン5:洗浄画分
- レーン6:溶出画分1
- レーン7:溶出画分2
- レーン8 溶出画分3
結果についてのコメント
N末端にHis-tagを付けた出芽酵母NAP™-1を大腸菌内で発現させ、菌体を50 mM Tris-HCl, 50 mM NaCl, pH 8.0, 0.1 M PMSFで懸濁した後、超音波で破砕した。大腸菌破砕液(input)を超遠心で前処理した後、遠心上清をHisTrap™ HPにアプライし、25 mM Tris-HCl, 0.5 M NaCl, 40 mM Imidazole, pH 7.4でカラムを洗浄した。その際に、非吸着画分1, 2および洗浄画分を5 mlずつ回収した。洗浄後のカラムから吸着したタンパク質を20 mM Tris-HCl, 0.5 M NaCl, 0.3 M Imidazole, pH 7.4で溶出し、2.5 mlずつ回収した(溶出画分1, 2, 3)。満足できる回収率と純度でNAP™-1を精製できた。
信州大学大学院 医学研究科 加齢生物学分野
森 政之 先生
HisTrap™ HPを使用した感想
- 使いやすい
- 収量が多い
- 性能的には高く評価できる。標準的な方法とはやや異なる使い方をしたが、クロマトグラフィーシステムを用いた方法も今後試したいと思う。
実験方法
[サンプル]
| 名称 | スクアレン合成酵素(ラット由来) |
|---|---|
| 溶液・濃度 | 10 ml (B-PER抽出液) |
| 発現系 | 大腸菌 |
[精製条件]
| 結合バッファー: | B-PER Reagent(PIERCE社) |
|---|---|
| 溶出バッファー: | エンテロキナーゼ消化による目的タンパク質の回収 |
[操作方法]
シリンジを用いたマニュアル操作
結果
| 収量 | 約 10 mg |
|---|
結果についてのコメント
今回は、イミダゾールによる溶出という標準的な方法ではなく、目的タンパク質をカラムに吸着させて非特異物質を洗浄した後に、エンテロキナーゼによりHis-tagと目的タンパク質との間を切断し、遊離されてくる目的タンパク質のみを回収するという方法をとりました。
結果としては、純度の高い目的タンパク質を得られたと考えています。
お問合せフォーム
※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。
お問い合わせありがとうございます。
後ほど担当者よりご連絡させていただきます。
© 2026 Cytiva
