|
|||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
|||||||||||
|
Location:Home > 実験手法別製品・技術情報 > アフィニティクロマトグラフィー |
|||||||||||
タンパク質精製のあとは??
|
|||||||||||
| カラム洗浄液 | 1 mM HCl(氷冷) |
|---|---|
| カップリングバッファー | 0.2 M 炭酸水素ナトリウム, 0.5 M NaCl, pH 8.3 |
| ブロッキングバッファー | 0.5 Mモノエタノールアミン, 0.5 M NaCl, pH 8.3 |
| 洗浄バッファー | 0.1 M 酢酸ナトリウム, 0.5 M NaCl, pH 4.0 |
| 平衡化バッファー | リガンドと目的タンパク質が安定に結合するバッファーを選択します。結合に金属イオンや補酵素などの添加物が必要な場合には、平衡化バッファーにも添加してください。 |
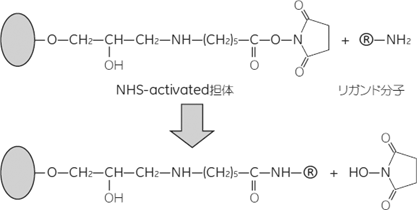
リガンド溶液の調製
- 一級アミノ基含有化合物の除去
- カップリング効率の低下を防ぐため、リガンド溶液中に1級アミノ基(-NH2)を含む化合物が存在する場合は、PD-10やHiTrap™ Desaltingカラムなどを用いて、指定のカップリングバッファーに交換してください。
- カップリングするリガンド量
- タンパク質の場合は、濃度を 0.5~10 mg/mlに調製します。
- リガンド溶液の体積
- カラム体積と同量のリガンド溶液をシリンジで注入します。リガンド溶液がカラム体積より多い場合には、2本のシリンジをカラムの両側に取り付けて交互に送液するか、ペリスタルティックポンプを接続してリガンド溶液をカラムに循環させます。
- リガンドの溶解性
- リガンドの溶解度が低い場合は、8 Mウレアや6 M塩酸グアニジン、界面活性剤などを用いて完全に溶解してからカラムに注入してください。
※変性剤を添加するとリガンドの立体構造が不可逆的に変化して、目的タンパク質が結合できなくなることがあるので、変性剤の使用には注意が必要です。保存中に沈殿を生じることもあるので、カラムに注入する直前に遠心(12,000×g、10分)または0.45 µmフィルターでろ過して不溶物を除去してください。
カップリングの手順
HiTrap™ 1 mlカラムのプロトコールです。5 mlカラムを使用する場合は、流速およびバッファー使用量を5倍にしてください。
- カラムの準備
- カラムに気泡を入れないように注意しながら、シリンジを接続
- 5 mlの1 mM HClを、流速1滴/秒(または0.2 ~ 1 ml/min)で送液
1 mM HCl送液後、すぐにリガンド溶液をカラムに添加してください。リガンド溶液添加の前に蒸留水でHCl を除去する必要はありません。
- カップリング反応
- 1 ml のリガンド溶液を、流速1滴/秒(または0.2~1 ml/min)で送液
- カラム出口を付属のストッププラグで密閉し、室温で15~30分間、または4℃で4時間放置
- 3 mlのカップリングバッファーを、流速1滴/秒(または0.2~1 ml/min)で送液
- 未反応活性基のブロッキング
- 6 mlのブロッキングバッファーを流速1滴/秒(または1~2 ml/min)で送液
- 6 mlの洗浄バッファーを流速1滴/秒(または1~2 ml/min)で送液
- 6 mlのブロッキングバッファーを流速1滴/秒(または1~2 ml/min)で送液、室温で15~30分間、または4℃で4時間放置
- カラムの洗浄と平衡化
- 6 mlの洗浄バッファーを流速1滴/秒(または1~2 ml/min)で送液
- 6 mlのブロッキングバッファーを流速1滴/秒(または1~2 ml/min)で送液
- 6 mlの洗浄バッファーを流速1滴/秒(または1~2 ml/min)で送液
- 平衡化バッファーを流速1滴/秒(または1~2 ml/min)で送液
- リガンド固定カラム作製完了
リガンド固定化アフィニティーカラムによる精製例
![]() 以下の精製例の詳細はこちらの「はじめてのリガンドカップリングハンドブック」の抜粋(PDF:410KB)をご覧ください。
以下の精製例の詳細はこちらの「はじめてのリガンドカップリングハンドブック」の抜粋(PDF:410KB)をご覧ください。
抗体固定カラムを用いた抗原の精製
抗BSA(ウシ血清アルブミン)ポリクローナルIgGを固定したカラムを使用して、1回の操作でウシ胎児血清から高純度なBSAを精製しました。
抗原固定カラムを用いた特異抗体の精製
マウスIgGを固定したカラムを使用して、抗マウスIgGを精製しました。
より高純度の抗体を得るために!
抗血清をそのままリガンド溶液としてカップリングカラムに添加するのではなく、Protein A/Protein GカラムによってIgGを精製し、それを抗原固定カラムに添加する2段階の方法も可能です。これにより、より高純度の抗体を得ることができる他、カラムの劣化を防ぐことができます。
お問合せフォーム
※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。
お問い合わせありがとうございます。
後ほど担当者よりご連絡させていただきます。
© 2026 Cytiva