|
|||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
|||||||||||||||||||||||||
|
Location:Home > 実験手法別製品・技術情報 > BIA(生物物理学的相互作用解析) |
|||||||||||||||||||||||||
Biacore™ & iTC 原理徹底解説1. Biacore™
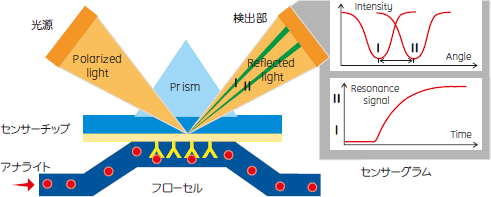
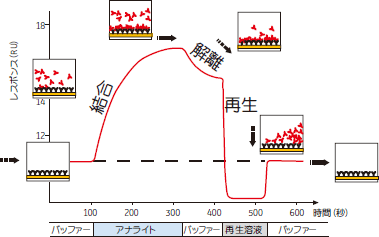
相互作用をみたい物質のうち一方(リガンド)をセンサーチップの金薄膜上に固定し、センサーチップの裏側から金薄膜とガラスの境界面で全反射するように光を当てると、反射光の一部に反射強度が低下した部分(SPRシグナル)ができます。相互作用をみたい物質の他方(アナライト)をセンサーチップの表面に流しリガンドとアナライトが結合すると、固定化されているリガンド分子の質量が増加し、センサーチップ表面の溶媒の屈折率が変化します。この屈折率の変化により、SPRシグナルの位置がIからIIにシフトします。 Biacore™システムはIからIIにシフトする量、すなわちセンサーチップ表面での質量変化を縦軸にとり、質量の時間変化を測定データとして表示します(センサーグラム)。センサーグラムのカーブからカイネティクス:結合速度定数(ka)と解離速度定数(kd)を、2つの定数の比からアフィニティー(KD)を求めることができます。
こんな場合におすすめ
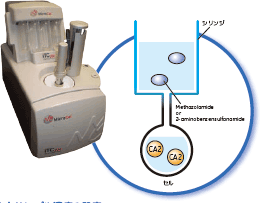
2. iTC
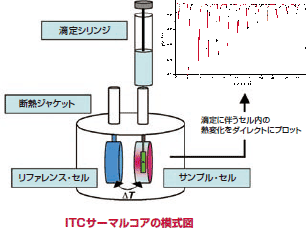
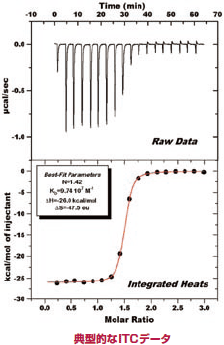
相互作用をみたい物質をサンプルセルと滴定シリンジにセットし、リファレンス(溶媒)をリファレンスセルに入れます。セルの温度を一定に保つため、2つのセルは断熱ジャケットで覆われています。一定温度に保たれたサンプルセルに滴定シリンジ中のリガンド溶液を数マイクロリットルずつ滴定し攪拌します。分子間相互作用により結合量に正比例した熱の発生または吸収が起こり、サンプルセル中の溶液温度が変化します。セルフィードバックネットワーク(CFB)はリファレンスセルとの温度差(ΔT)を感知し、ΔTが0になるようにセル表面の微小ヒータでリファレンスセルまたはサンプルセルを加熱します。ΔT=0を保持するために要したフィードバック電力を測定することで、相互作用による発熱量または吸熱量がわかります。滴定を続けることにより、結合サイトがリガンドで飽和されると観測される熱量は次第に小さくなり、最後はリガンドの希釈熱のみが観測されるようになります。 各滴定の発生熱量を縦軸に、セル中のリガンドとシリンジ中のタンパク質分子のモル比を横軸にとることで、結合等温線が得られます。結合等温線からは、アフィニティーの結合定数(KD)、反応の結合比(N)、エンタルピー変化(ΔH)、エントロピー変化(ΔS)が得られます。
こんな場合におすすめ
3. どちらか1つで解析すればよい?生体内での分子間相互作用にはさまざまな条件(濃度、生体分子の構造、周囲の分子の状態など)が複合的に関係しています。そのような系を理解するには、相互作用を特定の物理化学的な現象に着目して観測・解析することが有用です。例えば、Biacore™は結合に伴う質量変化を検出する事により、結合/解離のスピードを捉えることができます。これらの情報は生体内での分子動き(kinetics)を予測できます。一方ITCは結合時の化学反応を熱量変化として捉えることで、タンパク質の構造変化や結合の数、種類を予測することができます。これらの多角的な情報は、より薬効性が高く、副作用の少ない特異性の高い薬剤の開発に活用されています。 4. 実験例:Biacore™およびITCの使用サンプル量・濃度、測定結果について実験に使用したサンプル
Biacore™ T100での測定例固定化Sensor Chip CM5を用いたアミンカップリング法 アフィニティー測定事前のアフィニティー情報を参考に、その前後の濃度をアナライト濃度で調製。今回は、Methazolamide : 5 μM~0.5 nM、2-aminobenzensulfonamide: 50 μM~5 nMの範囲で11濃度、2.5倍希釈系列で測定(流速:30 μl/min、サンプルの添加時間:60 sec、温度:25℃)。 実験結果
iTC200での測定例
セル内サンプル濃度の設定iTCは事前に予測されるKDの値から、C値(C=[Protein]/KD)を算出します。一般的には、C値が1~1000になるようにセル内濃度を調製します。よって、セル内のサンプル濃度は事前に予測されたアフィニティー情報もしくは、他の手法より求めます。ここでは、Biacore™での実験結果を用いて濃度を算出しました。 Methazolamide測定時のCA2度を10 μM(C=435)、2-aminobenzensulfonamide測定時のCA2濃度を29 μM(C=22)(セル容量200 μl)。 シリンジ内サンプルの濃度設定シリンジ内のサンプル濃度は、滴定終了後に反応熱が完全に飽和するよう設定します。 ほとんどの場合、N(結合価数)=1の時はセル内サンプル濃度(この場合、CA2)の10倍濃度に設定します。 実験結果
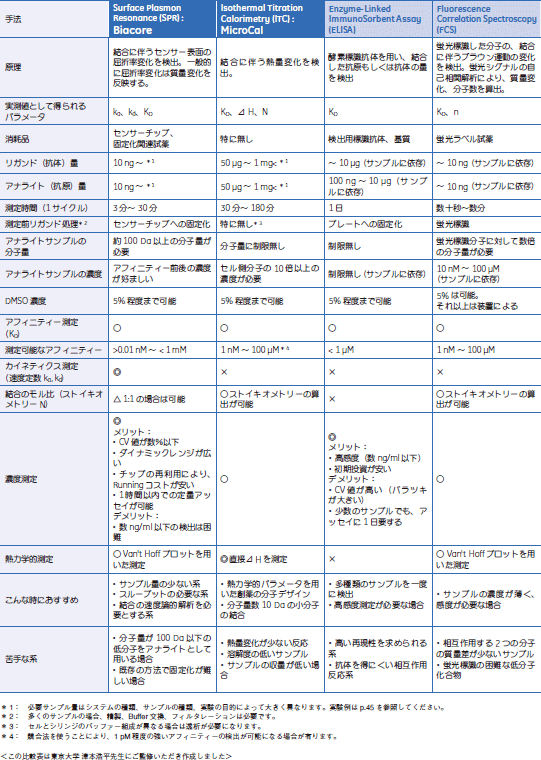
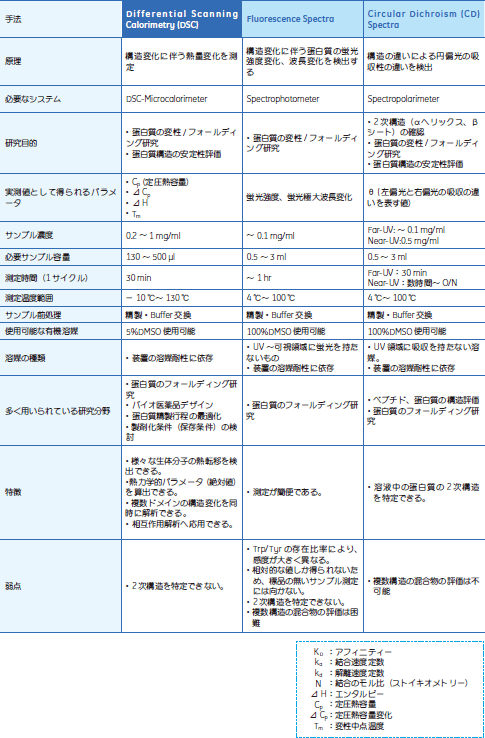
まとめ今回、Biacore™とITCを用いて同じサンプルでの相互作用測定を行った結果、アフィニティーKD、カイネティクスka、kdとエンタルピーΔH、ストイキオメトリーNを算出できました。アフィニティに注目すると、両者でほぼ同様の値を得ることができました。ITCにおいては、アフィニティーの弱いサンプルほどタンパク質と化合物共にサンプル量を要することがわかります。 特にITCはアフィニティーにより測定時の至適サンプル濃度を厳密に設定できるので、Biacore™でのアフィニティー測定の結果をITCの濃度決定に用いることは、有効な手段の一つと考えられます。 ※ ここではアフィニティの強いサンプルと弱いサンプル例をとりあげました。このほかにも10種類のサンプルで比較したデータがあります。詳細はお問合せください。 5. 分子間相互作用解析比較表6. タンパク質構造安定性評価比較表お問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
|||||||||||||||||||||||||
© 2026 Cytiva