|
||
|---|---|---|
|
|
||
|
Location:Home > 実験手法別製品・技術情報 > セルラーサイエンス |
||
マウス肝組織切片を用いたイメージング解析:成体肝臓における幹/前駆細胞反応の制御メカニズム第20回 日本サイトメトリー学会 ランチョンセミナー(2010年6月26日 東京慈恵会医科大学) 第20回日本サイトメトリー学会学術集会のランチョンセミナーで、東京大学分子生物研究所の伊藤暢先生にご所属の宮島研究室での取り組みとIN Cell Analyzer 2000を用いたイメージングサイトメトリーについてご講演いただきました。
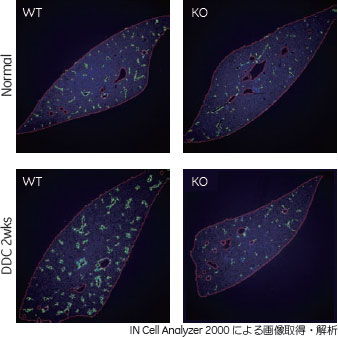
宮島研究室の取り組み宮島研究室では肝臓の発生、再生、あるいは病態の分子メカニズムを、主にマウスを用いて解析しています。血液学や免疫学の分野で使われている細胞の表面抗原分子・抗体およびフローサイトメトリーを用いた手法を、肝臓の研究分野にも適用し、肝臓構成細胞の同定と分離、解析を行っています。これまでに、肝臓を構成する種々の細胞における特異的な表面抗原分子を探索し、それらに対するモノクローナル抗体を作製してきました。肝臓の細胞を直接免疫したり、あるいは古典的な方法で分離した肝臓構成細胞における遺伝子発現解析や発現クローニング法などを用いてそれぞれの細胞種特異的な表面抗原を同定したりすることを通じて、モノクローナル抗体を充実させてきました。これらの抗体を用いたフローサイトメトリー、またセルソーティングを用いた個々の細胞種の分離、回収した細胞の性状解析、さらに種々の細胞のin vitro培養系の確立を経て、最終的には機能的な解析を行うという取り組みを進めています。 固形臓器におけるサイトメーター解析の問題点肝臓は固形臓器で、10種類ほどの細胞が特異的な位置関係を保って秩序だった組織構造を作っています。フローサイトメーター、セルソーターではそれらをバラバラにしてシングルセルの状態で解析せざるを得ません。当然ながら三次元の組織構造はなくなり、細胞の位置情報や元の形態情報、注目する細胞同士の関係、相互作用といった情報が失われてしまいます。また、バラバラにして回収する際にはバイアスがかかることがあります。肝臓の細胞を調製する際には、コラゲナーゼで灌流して細胞同士や細胞外マトリクスの結合をほぐします。すべての結合は均質ではないので実際にとれてくる細胞にばらつきが出てしまいます。また、どの部位の細胞が取れやすいのか分からないという問題も抱えていました。常々、こういった問題を克服し、そうした情報を付加した形で解析できる方法はないかと考えていました。そんな折にIN Cell Analyzer 2000が導入されることになり、イメージングサイトメトリーによって、これらの情報を保ったままフローサイトメトリーに近い解析を行うことはできないかということで取り組んでいます。 成体肝臓における幹細胞私のグループが興味をもって研究しているのは成体の肝臓における幹細胞/前駆細胞です。特に注目している、肝再生に関与している未分化な肝/前駆細胞についてお話します。 肝臓を構成する細胞の中で、上皮系の細胞として肝細胞と胆管上皮細胞があります。どちらも発生の過程で肝芽細胞という共通の前駆細胞から分化することがわかっています。肝芽細胞は肝細胞と胆管上皮細胞の共通前駆細胞であり、胎児期における幹/前駆細胞であると位置づけられています。成体の肝臓には肝芽細胞は存在しません。ホメオスタティックなメンテナンス(細胞の新陳代謝)や部分肝切除、軽度な肝障害の場合にはすでに分化している肝細胞や胆管上皮細胞がそれぞれ増殖して再生、メンテナンスしていると考えられています。ところが肝臓がある種の重篤な、慢性的な肝障害にさらされると、肝細胞自身の増殖が阻害されます。そのような肝臓では、未分化性を有した「オーバル細胞」と呼ばれる細胞が出現し、これが肝細胞や胆管上皮細胞に分化することで再生を担うとされています。 IN Cell Analyzer 2000を用いたサイトメトリー解析本研究では、マウスにおけるオーバル細胞誘導系のうち、肝臓に障害を与えるDDCという毒物を含む食餌を投与するモデルを使用しました。オーバル細胞を同定するマーカーは、代表的な像としてCK19を用いました。 一般的に組織幹細胞の維持には周囲の微小環境を構成するニッチ細胞が関連しており、様々なニッチシグナルが作用することが知られています。我々は、肝臓のオーバル細胞に対しても何らかのニッチ細胞というものが存在し、ニッチシグナルを発しているのではないかと考えています。種々のマーカーを用いた細胞の解析から、DDCで障害を与えた肝臓ではCK19 染色されるオーバル細胞が出現し、その周囲に表面抗原Thy1で染まる細胞群が常に隣接して出現することを見出しました。このようなThy1陽性の細胞は間葉系の細胞だと考えられていますが、これらがオーバル細胞に対してニッチのようなものを提供し、さらにシグナルを与えていると仮定しました。 上皮.間葉間相互作用に関わる種々のシグナルについて検討を行った結果、オーバル細胞制御に関わるシグナルの候補となる分泌因子を見出しました(以下、「候補分子」)。遺伝子発現解析の結果から、Thy1陽性細胞がこの「候補分子」を発現、産生し、そのレセプター分子を発現しているオーバル細胞に作用するというモデルを考えています。 この「候補分子」がオーバル細胞の誘導に真に必要なのか確認するため、その遺伝子欠損マウスを用いた解析を行いました。この遺伝子欠損マウスはすでに知られていますが、肝臓の発生や通常のメンテナンスの異常は報告されていません。このマウスに対してDDCを投与することで肝障害を誘発し、その際のオーバル細胞の出現を種々のマーカーを用いて解析しました。図1は抗CK19抗体染色サンプルをIN Cell Analyzer 2000で撮影し、画像解析を行ったものです。
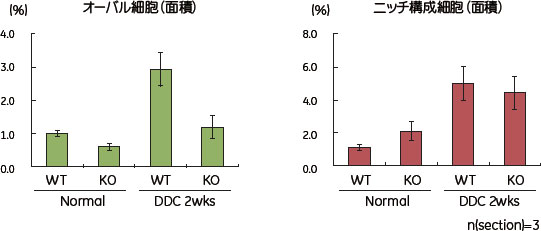
緑色のシグナルは、CK19染色で陽性のオーバル細胞です。赤い部分は肝臓の輪郭を認識させています。DDCで障害を与えた場合に、オーバル細胞の増殖が野生型では認められますが、候補分子欠損マウスでは顕著に抑えられているように見えます。Thy1陽性のニッチ構成細胞についても同様に解析を行いましたが、野生型と遺伝子欠損マウスとで違いは見られませんでした(図2)。
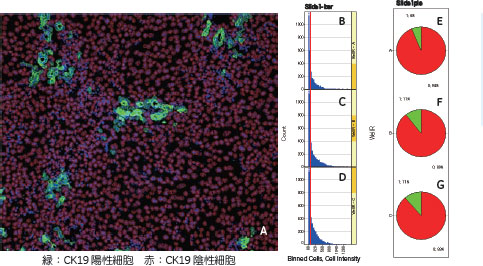
DDCで障害を与えた場合、まずThy1陽性細胞が何らかのシグナルで増殖し、これが「候補分子」を供給することでCK19陽性のオーバル細胞の出現、増殖が起こると考えています。さらに、この「候補分子」だけでオーバル細胞の出現を誘導できるか調べるため、その遺伝子の発現ベクターをHTVi(Hydrodynamic Tail Vein injection)法を用いて導入しました。HTVi 法はプラスミドベクター等をマウスの尾静脈から比較的大量(体重の10%相当)の緩衝液と共に短時間、5 から7 秒ぐらいで一気に注入するというもので、そのメカニズムは完全には解明されていませんが、肝臓に効率よく遺伝子導入できるという手法です。この系を用いて、正常なマウス肝臓に「候補分子」を導入し過剰発現させると、CK19陽性のオーバル細胞に類似した細胞の出現が見られました。このことから「候補分子」がオーバル細胞の活性化・出現に必要かつ十分であることがわかりました。 現在、オーバル細胞の制御に関わると考えられる他の様々な分子についても、HTVi法による遺伝子導入とIN CellAnalyzer 2000を用いた定量解析により、その機能評価を進めています(図3)。
今後は、多重マーカー染色によるより詳細な細胞の性状解析、細胞内シグナル伝達分子の活性化状態の評価、細胞の位置関係の評価、細胞の大きさの定量化、共培養系での幹/前駆細胞および支持細胞の動態解析などにもIN Cell Analyzer 2000を応用していきたいと考えています。 お問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
||
© 2025 Cytiva