|
||
|---|---|---|
|
|
||
|
Location:Home > 実験手法別製品・技術情報 > セルラーサイエンス |
||
High Content Analysis 技術を用いた内臓脂肪細胞の多量イメージング解析はじめに糖尿病をはじめとした高脂血症、高血圧症、動脈硬化症などの生活習慣病発症の主要因は、食生活の欧米化に伴う「内臓脂肪」の過剰蓄積であることが、臨床レベルで解明されています。しかし、これまで内臓脂肪細胞の分化誘導系がなく、そのメカニズムは不明な点が多くありました。 ここでは、High Content Analysisを目的として開発されたIN Cell Analyzer 1000を用い、脂肪の蓄積を阻害すると考えられる数種の薬剤を投与した際、VAC01細胞*の脂肪蓄積にどのような影響を及ぼすか解析しました。 *VAC01内臓脂肪細胞培養キット
実験内容使用した製品
*アップグレードが必要です。 試薬
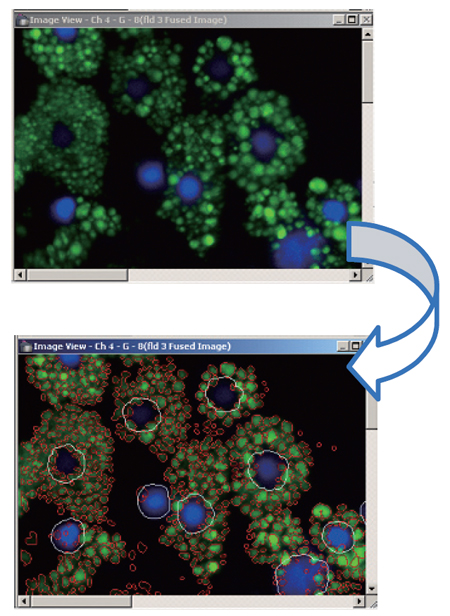
実験操作(図1参照)
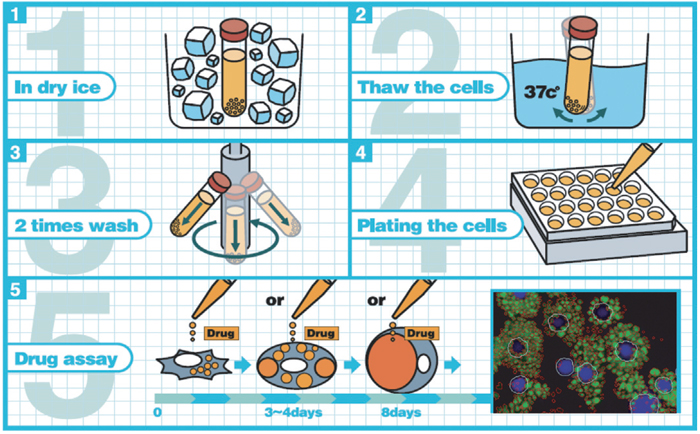 図1 内臓脂肪細胞に蓄積した脂肪の解析スキーム
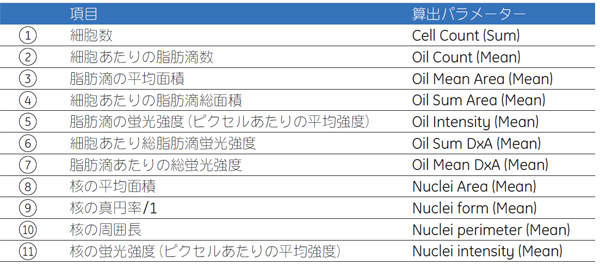
解析パラメーター細胞核はHoechst™ 33528による染色、脂肪滴は脂溶性蛍光色素であるBODIPY™ 493/503を取り込ませ検出しました。画像解析ソフトウェアIN Cell Investigator により各パラメーターを算出し評価を行いました(表1)。 表1 IN Cell Investigator で算出した評価パラメーター
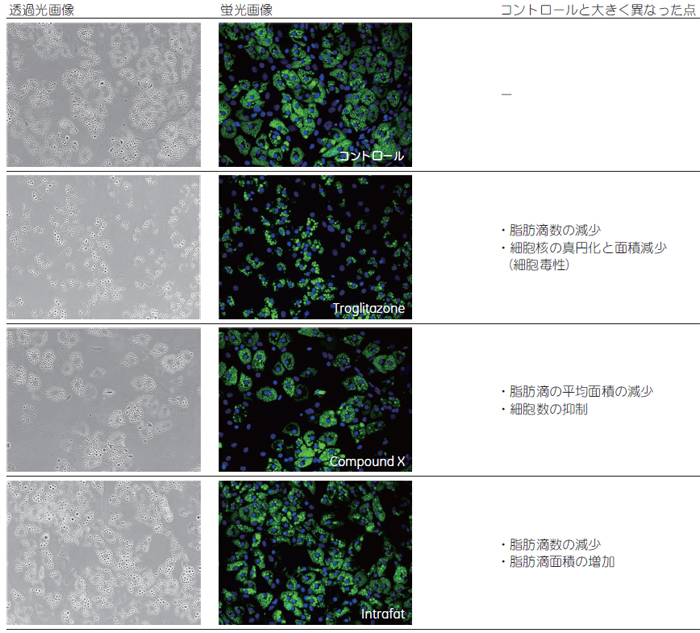
結果表現系の変化についてIN Cell Analyzer 1000 で取り込んだ脂肪細胞の透過光画像および蛍光画像を示します(図2)。ソフトウェアによる画像認識で各 パラメーターを数値化し(図3)、薬剤処理サンプルとコントロール で比較を行いました。
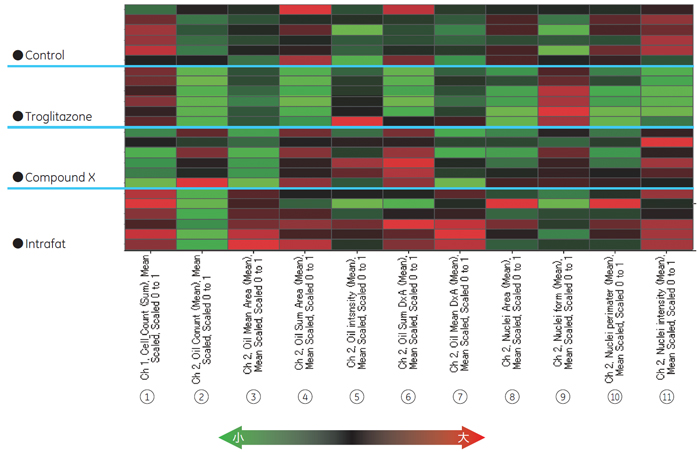
インスリン抵抗薬剤であるTroglitazone処理では、脂肪滴数は減少しましたが、細胞核の真円化と面積減少が認められました。油成分を含むIntrafat 処理では、脂肪滴数は減少しているものの脂肪滴面積の増加が確認されました。 評価化合物であるCompound X処理では、コントロールに対して脂肪滴の平均面積が減少し、さらに、脂肪細胞の数が抑制されていることが確認されました。 図4は、薬剤処理サンプルとコントロールサンプル間で各パラメーター変動の傾向を比較したヒートマップです。
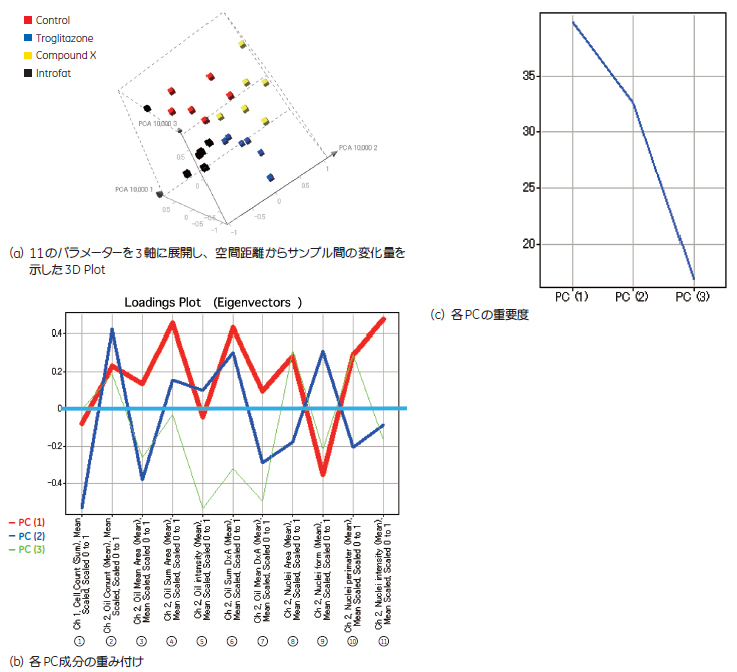
PCA解析によるパラメーター評価PCA解析により、IN Cell Investigator で算出した11種のパラメーターの評価を行いました(図5a, b, c)。その結果、「細胞あたりの脂肪滴総面積(Oil Sum Area)」と「細胞あたりの脂肪滴数(Oil Count)」の変量幅が大きく、薬剤評価を行う際に最も重要なファクターであることが示されました。反対に、「脂肪滴の平均蛍光強度」には大きな変化が認められないことがわかりました。 これらから、薬剤が脂肪蓄積に与える影響を評価する場合では、1細胞あたりに占める脂肪滴の面積および数がスクリーニング評価に適したパラメーターであることがわかりました。
まとめ本報で示したIN Cell Analyzer 1000による脂肪蓄積評価では、 取得した細胞蛍光画像から複数パラメーターを一度に算出して統 計解析することで、脂肪蓄積の薬効評価に最適なパラメーターを 選ぶことができました。 このように、細胞蛍光画像をもとにしたスクリーニング解析では、 細胞形状や面積などを評価指標とできることが特長です。High Content Analysis を目的として開発されたIN Cell Analyzer 1000では、鮮明な蛍光画像を取得するとともに、専用ソフトウェ アのIN Cell Investigator、またSpotfire DecisionSite™ Statisticsを用いることで、効率良く精度の高いスクリーニングが実施でき ます。 ※本研究アプリケーションの開発にご協力いただいた、株式会社プライマリーセル 尾田千佳子様と平敏夫様、日本ティブコソフトウェア株式会社 大石尚孝様に深く感謝いたします。 お問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
||
© 2025 Cytiva