|
||
|---|---|---|
|
|
||
|
Location:Home > 実験手法別製品・技術情報 > セルラーサイエンス |
||
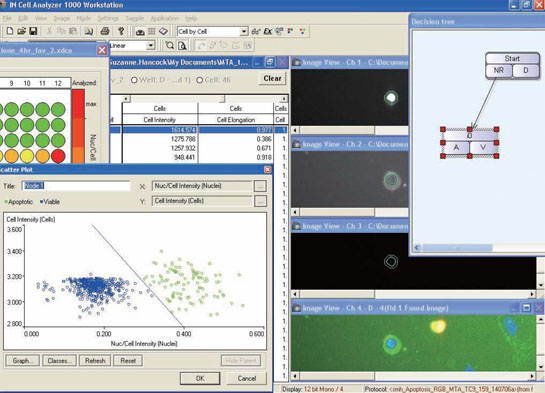
浮遊細胞を用いたイメージングサイトメーターによるアポトーシス解析はじめに解析ソースとして細胞イメージを用いるイメージングサイトメーターでは、接着細胞や組織切片でも、測定の際に剥離、分散といった操作をせずに、細胞個々のイメージから蛍光強度、面積、長さ、真円率等の形態情報やタンパク質の局在情報が取得できます。さらに従来のフローサイトメーターのようなポピュレーション解析も可能です。個々の細胞イメージと数値データを相互リンクしているので、必要に応じて、ポピュレーション解析で得られた特徴的な数値データを持つ細胞について、形態観察や数値確認も行えます(図1)。 今回はIN Cell Analyzer 1000を用いた浮遊細胞のアポトーシス解析例をご紹介します。アポトーシス解析では従来、フローサイトメーターによる解析が多く行われています。イメージングサイトメーターを用いることで、ポピュレーション解析だけでなく、核の断片化などの形態変化もあわせて検出することができました。また、焦点を合わせにくく、均一な画像を取るのが難しいとされている浮遊細胞も遠心することで問題なく解析することができました。
使用した製品
サンプルおよび試薬
※Annexin V、Propidium Iodide(PI)はアポトーシス細胞のステージを識別するためのマーカーです。Annexin V はアポトーシス初期以降の細胞を全体的に染色します。PIは死細胞の核を染色します。アポトーシス後期以降の核が染まります。Hoechst™ 33342は生死を問わず核を染色します。 実験方法Jurkat細胞を、10 µM Camptothecineで5時間処理、50 µM Camptothecineで5時間処理、95℃2分間処理の3通りの方法で細胞死を誘導しました。その後下記の手順に従いAnnexin V、Propidium Iodide(PI)、Hoechst™ 33342で細胞の染色を行いました。
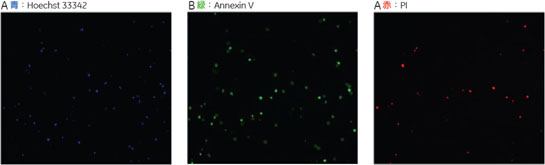
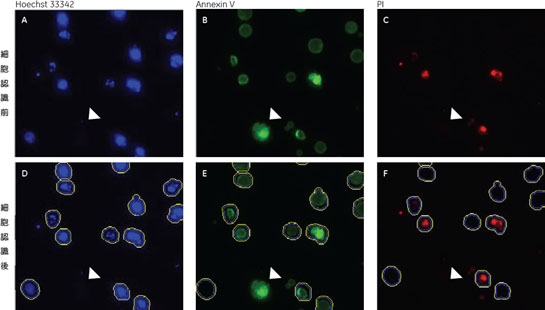
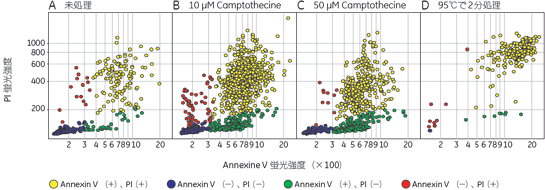
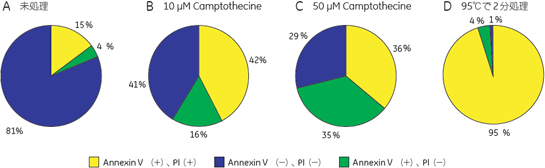
結果10 µM Camptothecine処理を行った細胞をIN Cell Analyzer 1000で撮影した画像を図2、3に示しました。図3には画像解析ソフトウェア、IN Cell Investigator Softwareにより細胞を認識させた結果も示しました(図3)。Hoechst™ 33342で染色された核を元に認識しました(図3D~F)。細胞から抜け出してしまった核は認識の対象外となっています(図3中△印)。このように指定した条件のものを対象から除外することもできます。 それぞれ処理を行った細胞をIN Cell Investigator Softwareで認識し、横軸にAnnexin Vの強度、縦軸にPIの強度をとりプロットした結果を図4に示しました。各ステージの細胞の割合が分かるよう図5にPie Chartも示しました。図4、5よりCamptothecine処理で濃度依存的に生細胞(Annexin V -、PI -)の割合が減少し、初期アポトーシス細胞(Annexin V+、PI -)が増加しており、95℃ 2分間処理で大幅に細胞死(Annexin V+、PI +)が誘導されている様子が確認できました。
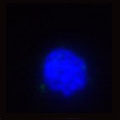
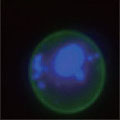
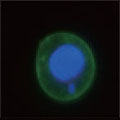
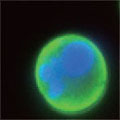
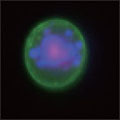
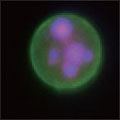
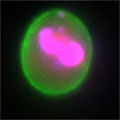
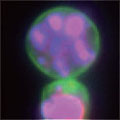
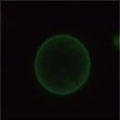
A 生細胞 Hoechst™ 33342(+)、Annexin V(-)、PI(-) B 初期アポトーシス細胞 Hoechst™ 33342(+)、Annexin V(+)、PI(-) C 中期~後期アポトーシス細胞 Hoechst™ 33342(+)、Annexin V(+)、PI(+) D 脱核した細胞 Hoechst™ 33342(-)、Annexin V(+)、PI(-) また、60×レンズを用いることで細胞内の形態変化を確認することが可能です。図6に50 µMで処理した細胞イメージを示しました。 Aは生細胞を示しています。核がHoechst™ 33342(青)だけで染色されています。Bは初期アポトーシス細胞です。細胞全体がAnnexin V(緑)で染色されています。Cは後期アポトーシス細胞です。核が断片化され、小粒状になっている様子が観察されます。この細胞イメージからさらに核の大きさ、数などの情報を得ることも可能です(データ未掲載)。 まとめ
お問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
||
© 2025 Cytiva