イメージングサイトメーターとフローサイトメーターによる細胞周期解析結果の比較
はじめに
イメージングサイトメーター、IN Cell Analyzer 2000は細胞を高速でイメージングし、そこから得られる情報を迅速に数値・定量化できるシステムです。得られた画像から個々の細胞内の蛍光強度を算出し、ポピュレーション解析を行うことができるのに加え、一般的なフローサイトメーターでは得られなかった形態情報や分子局在情報、タイムラプスなども解析可能です。
本報ではフローサイトメーターとイメージングサイトメーターを用いて細胞周期解析をおこない、結果を比較するとともに、イメージングサイトメーターの優位性についても確認を行いました。
使用した製品
機器
- イメージングサイトメーター、IN Cell Analyzer 2000
- IN Cell Investigator
- 市販フローサイトメーター(A社)

試薬
- 細胞:HeLa
- 細胞周期用染色キット(A社フローサイトメーター推奨品)
- Paclitaxel(SIGMA T-7194)
- Nocodazole(SIGMA M1404)
- 0.05 % Trypsin-EDTA( GIBCO™ 25300)
- 99.5 % エタノール(関東化学 14033-2B)
- DMSO(SIGMA D2650)
- PBS(GIBCO™ 14190)
方法
IN Cell Analyzer 2000測定用サンプルの調製
- HeLa 細胞を96 wellプレートに20,000 cells/wellで播種し一晩培養
- 無血清培地に交換し24時間培養
- 血清培地で濃度調整した薬剤を添加後24時間培養薬剤濃度は下記のとおり
Nocodazole 1 µM、0.1 µM
Paclitaxel 1 µM、0.1 µM
溶媒コントロール 1 % DMSO
- PBS で洗浄 2 回
- 氷冷した70 % エタノール 200 µl/wellを添加し、4℃で60分間インキュベーション
- PBS で洗浄 2 回
- 細胞周期用染色キット(A社フローサイトメーター推奨品)
200 µl/well 添加し、遮光下、室温にて30分間インキュベーション
- ウェル内の染色液を除きPBS 200 µl/well を添加
- IN Cell Analyzer 2000にて測定
測定には2D デコンボリューションモード、20倍対物レンズを使用しました
On line Cell Counting 機能を使い、1 wellにつき約5,000個の細胞を撮影しました
- 解析ソフトウェアIN Cell Investigatorにて解析
Flat Field Correction機能を使用しました
市販フローサイトメーター(A社)測定用サンプルの調製
- HeLa 細胞を24well プレートに100,000 cells/wellで播種し一晩培養
- 無血清培地に交換し24時間培養
- 血清培地で濃度調整した薬剤を添加後24時間培養薬剤濃度は下記のとおり
Nocodazole 1 µM、0.1 µM
Paclitaxel 1 µM、0.1 µM
溶媒コントロール 1 % DMSO
- Trypsin-EDTAを用いて細胞をフラスコから剥がし、培地に懸濁してエッペンチューブに回収
- 遠心(1,000×g、5 min、室温)し上清を除去後PBSを添加し洗浄 2 回
- 遠心(1,000×g、5 min、室温)し上清を除去
- 氷冷 70% エタノール 200 µl/tubeを添加して4℃で一晩インキュベーション
- 遠心(1,000×g、5 min、室温)し上清を除去後PBSを添加し洗浄 2 回
- 細胞周期用染色キット(A社フローサイトメーター推奨品)
200 µl/tube添加して、遮光下、室温にて30分間インキュベーション
- 市販フローサイトメーター(A社)にて1チューブにつき5,000細胞を測定
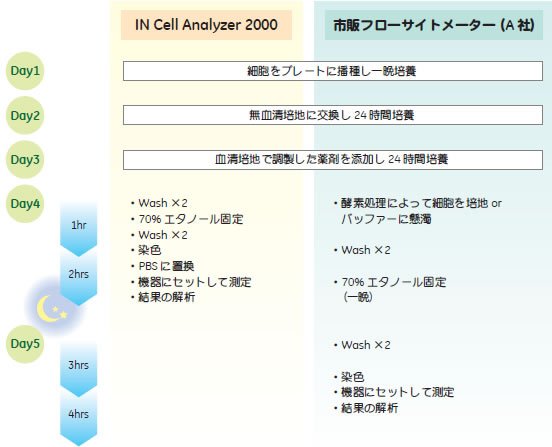
図1 実験手順の比較
Day 4以降で比較するとIN Cell Analyzer 2000では細胞をプレートに接着したままで解析できるため、溶液交換のたびに遠心分離が不要で実験作業を大きく効率化できます。
結果
市販フローサイトメーターおよびIN Cell Analyzer 2000を用いて、Paclitaxel処理した細胞についてPaclitaxel 濃度が細胞周期に与える影響を確認しました(図2) 。その結果、市販フローサイトメーター、IN Cell Analyzer 2000とも、0.1 µM、1.0 µM Paxitaxel処理細胞で、コントロールに対して顕著なG2/M期の増加がみられました。また、Nocodazole処理した細胞では、1.0 µM Nocodazole処理細胞でG2/M期の増加がみられました(図3)。
さらにIN Cell Analyzer 2000では、解析用に取得した細胞画像を確認することが可能です(図4) 。Paclitaxelを添加することで核が凝集したG2/M期の細胞が増加していることが分かります。解析後の画像には、各細胞にソフトウェアが判断した細胞周期のフェーズ(G1、S、G2/M、M4)が表示されるので、解析結果を目視で確認し、ソフトウェアの正確性をチェックすることもできます (図5) 。
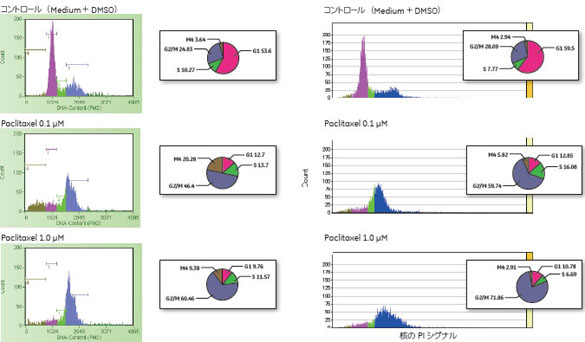
図2 Paclitaxel 処理後の細胞周期分布
市販フローサイトメーター(左)とIN Cell Analyzer 2000(右)での測定結果
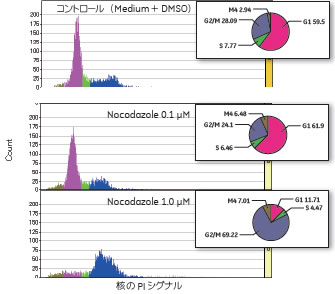
図3 Nocodazole処理後の細胞周期分布
IN Cell Analyzer 2000での測定結果


図4 IN Cell Analyzer 2000で撮影した画像。
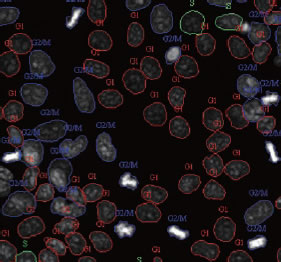
図5 細胞拡大図
画像解析後には細胞それぞれに細胞周期のフェーズが記されます。
赤:G1、緑:S、青:G2/M
まとめ
細胞周期解析をおこなった結果、イメージングサイトメーターでもフローサイトメーターと同様の薬剤添加による細胞周期の変化を測定することができました。さらにイメージングサイトメーターでは、解析後に細胞画像とソフトウェアが判定した細胞周期を確認し、解析の正確性を確認することが可能です。
また、接着細胞に剥離ダメージを与えずに測定できるメリットがある上、遠心分離の操作が不要なため、フローサイトメーターを使用する実験系よりも実験作業を大きく効率化できました。







