
印刷用PDF
IN Cell Analyzer 2000を用いた細胞シートの血管形成評価
はじめに
多くの薬剤スクリーニングシステムは細胞を対象としたもので、組織を対象としたものは依然未熟で、発生学的に類似した生物現象を模擬した新しい培養系が望まれています。
培養細胞集塊は、独立した細胞の集合体に、細胞間コミュニケーションを有し機能発現に至る過程を表現できるいわゆるミニマムティッシュと考えられ、培養フォーマットとして有望です。種々の幾何を有する集塊の調整は、球状や板状での集塊が考えられます。球状集塊は、その形成手段は簡易ですが、集塊内での血管ネットワークなど複雑な(無秩序な)模様を解析する際、3次元的解析が必要で、その評価方法が煩雑となります。そこで、秩序をもつ培養フォーマットとして板状集塊での解析が望まれます。
今回、培養フォーマットとして単層細胞シート積層法を採用し、IN Cell Analyzer 2000を用いて、筋芽細胞積層シート内における血管内皮細胞のネットワーク定量を試みました。
実験内容
使用した製品
- IN Cell Analyzer 2000
- IN Cell Investigator Software
サンプルおよび試薬
- ヒト骨格筋筋芽細胞
- ヒト臍帯静脈内皮細胞(HUVEC)
- CellTracker™ Orange CMTMR,Molecular Probes
- Monoclonal Mouse Anti-human CD31,DAKO
- Alexa Fluor™ 488 goat anti-mouse IgG,Molecular Probes
- DMEM培地(筋芽細胞用培地)
- EBM-2培地(内皮細胞用培地)
方法
細胞シート形成技術については、東京女子医科大学とセルシードが開発した温度応答性培養皿を用い、シート化と積層化の2つの工程を経た単層細胞シート積層法(Tsuda Y. et al. Biomaterials, 28, 4939-4946 (2007))を用いました(図1)。

図1 細胞シート(板状細胞集塊)
細胞シートは、そのシートを構成する充填細胞(繊維芽細胞、筋芽細胞など)、シート内で棲み分けされるターゲット細胞(血管内皮細胞など)、投与薬剤(培地、増殖因子など)の3要素からなり、秩序だった構造物におけるターゲット細胞の挙動解析を可能とします。
細胞シートの充填細胞には、CellTracker™ Orangeで染色したヒト骨格筋筋芽細胞を用い、ターゲット細胞であるヒト
臍帯静脈内皮細胞の播種密度を5.0×103 cells/cm2、1.0×104 cells/cm2の2種類で播種しました。また、細胞シートを培養する培地として、DMEM培地およびEBM-2培地を用いました。96時間培養後に固定化し、Anti-human CD31抗体およびAlexa Fluor™ 488標識二次抗体を用いて、染色しました。
染色したサンプルは、IN Cell Analyzer 2000を用いて、画像取得および血管内皮細胞のネットワーク形成の評価を行いました(図2)。
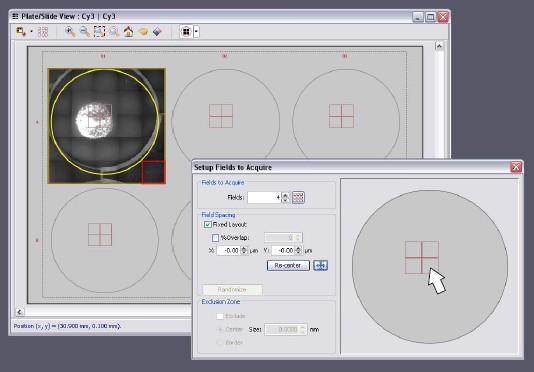
図2 プレビュースキャン機能による撮影ポジションの決定
IN Cell Analyzer 2000はプレビュースキャン機能を搭載しており、本撮影前に短時間でプレビューが可能です。これにより、ウェル内に均一に播種された細胞でなくとも、サンプルポジションを確認した上で、測定視野を設定することが可能です。
結果
IN Cell Analyzer 2000は、400万画素のlarge-chip CCDカメラが搭載可能であり、24ウェルプレートで作製した細胞シートを、2xレンズで4視野撮影+画像スティッチングすることで、シート全体のイメージングが行えます(図3)。撮影後、解析ソフトウェアIN Cell Investigatorを用いて、血管内皮細胞のネットワーク形成を評価しました(図4)。
その結果、いずれのサンプルにおいても、細胞シートの中で大きな一つのネットワークが形成され、その他に細かな断片が存在していることが分かりました。また、DMEM培地よりEBM-2培地で培養したサンプルにおいて、ネットワーク総長が長い傾向が確認されました(図4)。
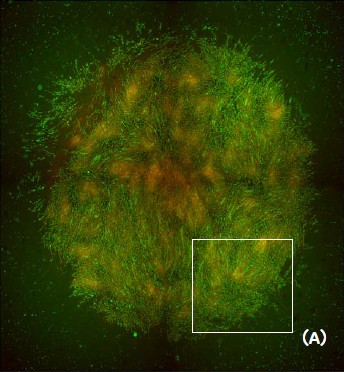
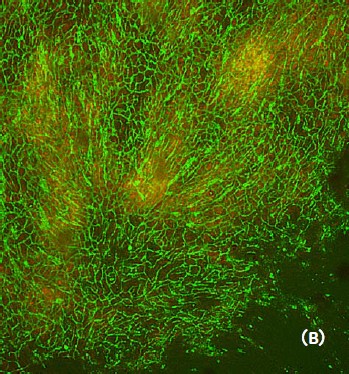
図3 ヒト骨格筋筋芽細胞シート
(A)全体像(2xレンズ4視野撮影によるスティッチング画像)、(B)一部拡大像((A)□部)。緑:血管内皮細胞のネットワーク(Alexa Fluor™ 488標識)、赤:ヒト骨格筋筋芽細胞シート(CellTracker™ Orange CMTMR染色)。より鮮明な画像を得るため、2D Deconvolution modeを使用しています。


図4 Developer toolboxによる画像認識の様子
(A)全体像(2xレンズ4視野撮影によるスティッチング画像)、(B)一部拡大像((A)□部)。黄色:細胞シート外周、赤:血管内皮細胞のネットワーク外周、緑:血管内皮細胞のネットワーク中心部分。緑でなぞられた部分からネットワークの総長を算出しました。
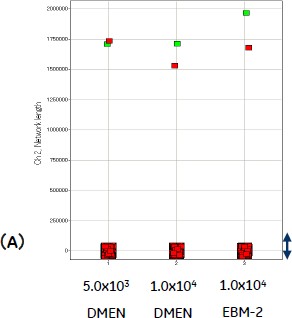
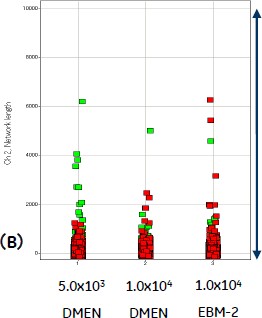
図5 血管内皮細胞の播種数および培地の違いによるネットワーク形成の違い(n=2)
(A)細胞シート内のネットワークの長さ(Scale 0 - 2,000,000)、(B)細胞シート内のネットワークの長さ((A)のうちScale 0 - 10,000を拡大)。赤と緑は同条件で培養した、異なるウェルのプロットを示します。細胞シートの中で大きな一つのネットワークが形成され、その他に細かな断片が存在していることが分かります。
まとめ
- Large Chip CCDカメラにより、2xレンズ4視野撮影と画像スティッチングで細胞シート全体のイメージングが可能です。
- プレビュースキャン機能により、ウェル内に偏在する細胞(細胞塊)であっても簡便に測定視野の設定が可能です。
- 汎用解析ソフトDeveloper toolboxにより、細胞ネットワークの長さが計測でき、細胞播種数、培地による違いが確認されました。
データご提供
大阪大学大学院
工学研究科生命先端工学専攻
生物プロセスシステム工学領域
紀ノ岡 正博先生









