
印刷用PDF
IN Cell Analyzer 2000 による Fucci 導入細胞の細胞周期測定
はじめに
Fucci(Fluorescent Ubiquitination-based Cell Cycle Indicator)は細胞周期の進行をモニターするために有用なプローブとして知られています。
細胞周期の特定の時期にのみ発現するGeminin に緑色(monomeric Azami-Green1: mAG1)の蛍光タンパク質を、Cdt1 にオレンジ色(monomeric Kusabira-Orange2: mKO2)の蛍光タンパク質を融合して細胞周期を可視化できるようにしたプローブです。Fucci を細胞に導入するとS/G2/M 期に緑色、G1 期にオレンジ色の蛍光が核に観察されます。
Cycle inhibiting Factor(Cif)は細菌の病原因子分泌系であるtype III secretion system(TTSS)を通じて上皮細胞内に運ばれるエフェクターのひとつです。腸管病原性大腸菌(enteropathogenic Escherichia coli, EPEC)や腸管出血性大腸菌(enterohemorrhagic Escherichia coli, EHEC)により分泌されています。Cif ファミリータンパク質はEPEC、EHEC、仮性結核菌(Yersinia pseudotuberculosis)、Photorhabdus luminescens、類鼻疽菌(Burkholderia pseudomallei)で高度に保存されたタンパク質であり、宿主細胞の細胞周期の進行を阻害します。
EPEC 感染細胞では、分泌されたCycle inhibiting Factor(Cif)がユビキチン類似タンパク質である Nedd8 と結合することで細胞周期進行に必要なタンパク質の分解が抑制され、G1 期に細胞周期が停止することが知られています。(Hanako Morikawa, et al. BBRC 401 (2010) 268-274)。
本アプリケーションノートでは、細胞周期インジケーターFucci を導入した細胞を使って、EPEC 感染下の細胞周期の進行を観察し、感染した細胞はG1 期で細胞周期が停止することを測定しました。またIN Cell Analyzer 2000 を用いることで細胞画像から自動的に個々の細胞の細胞周期を特定しました。
使用した製品
機器
- IN Cell Analyzer 2000
- IN Cell Investigator
Materials
細胞:
Fucci 導入 HeLa 細胞
細菌株:
wild-type rabbit EPEC O103:H2 strain(E22)
(O. Marches, T.N. Ledger, M. Boury, et al., Mol.
Microbiol. 50 (2003) 1553-1567.)
E22 cif 欠損株(Δcif)
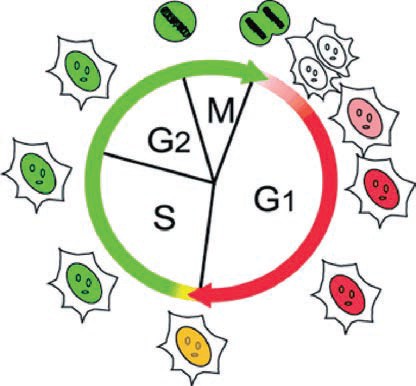
図1 Fucci 技術により、細胞周期の進行に応じて細胞の核の色が変化する様子。
資料提供:
(独)科学技術振興機構 ERATO 宮脇生命時空間情報プロジェクト
(独)理化学研究所 脳科学総合研究センター 細胞機能探索技術開発チーム
阪上(澤野)朝子 先生、宮脇 敦史 先生
方法
サンプル調製
96well プレートにFucci を導入したHeLa 細胞を播種、培養しE22、Δcif を感染させました。感染後3 時間経ったところで、100 µg/ml ゲンタマイシン、60 µg/ml カナマイシンを細胞培養培地に添加し細菌を死滅させます。
その後細胞を37 ℃でインキュベートし、24 時間後に細胞を固定し(4% PFA)、DAPI 染色を行いました。溶液はPBS に置換しました。
IN Cell Analyzer 2000 にて測定
20 倍対物レンズを使用して細胞画像を撮影しました。
On line Cell Counting 機能を使い、1 well につき約5,000 個の細胞を撮影しました。On line Cell Counting 機能は細胞数を数えながら測定し、任意に設定した数に達するまで自動的に画像を撮影する機能です。撮影した画像を用い、解析ソフトウェアIN Cell Investigator にて解析しました。
結果
IN Cell Analyzer 2000 で得られた画像(図2)より、E22 を感染させたウェルでは、non-infected に比べ顕著にKusabira-Orange2 のシグナルが増加していました。Kusabira-Orange2 はG1 期のインジケーターであり、このことからG1 期で細胞周期が停止していることが示唆されます。一方、Δcif 感染させたウェルではG1 期の増加はみられませんでした(図2)。
次に数値化のため、解析ソフトウェアInvestigator による画像解析を行いました。
DAPI 染色画像から、細胞の核をすべて認識し、その領域のAzami-Green1 シグナル、Kusabira-Orange2 シグナルを測定しました(図3)。得られた数値を2D プロットに展開し、閾値を設定して次の4 群にわけました(図4)。
- G1:
Kusabira-Orange2 ポジティブ、Azami-Green1 ネガティブの集団
- G1/S:
Kusabira-Orange2 ポジティブ、Azami-Green1 ポジティブの集団
- S/G2M:
Kusabira-Orange2 ネガティブ、Azami-Green1 ポジティブの集団
- Division(分裂直後):
Kusabira-Orange2 ネガティブ、Azami-Green1 ネガティブの集団
IN Cell Investigator を使用することで、各細胞の周期を自動的に判別できます(図4)。すべてのウェルでの各細胞周期の数値をグラフ化しました(図5)。
non-infected のB の列では、G1 期が36 ~ 40 %、S/G2/M期の増殖期の細胞は38 ~ 40 %でした。一方、E22 を感染させたD の列ではG1 期が59 ~ 63 %、S/G2/M 期の増殖期の細胞はほとんど見られませんでした。
Δcif 感染のF の列では各細胞周期の割合はnon-infected と同程度でした。以上より、Cif タンパクが細胞周期をG1 期でアレストしていることがわかりました。
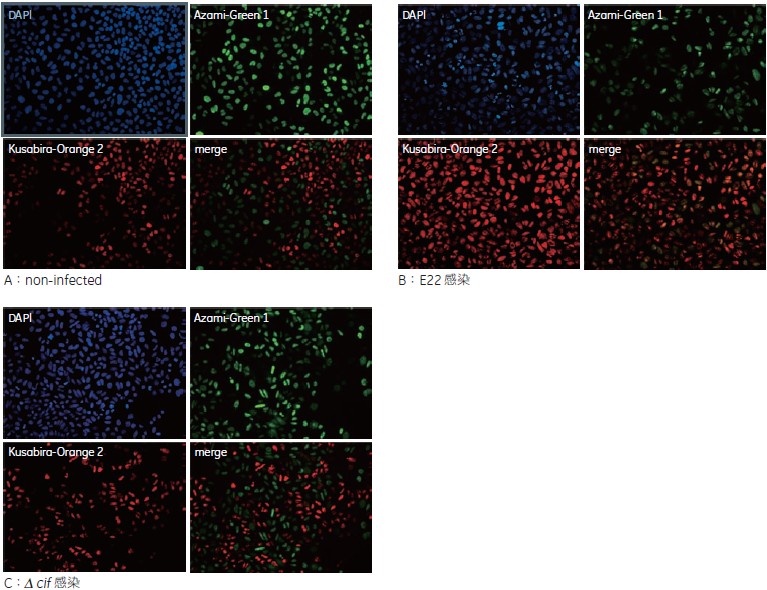
図2 各 well の画像
E22 を感染させたB ではA、C に比べ顕著にG1 期のインジケーターであるKusabira-Orange2 のシグナルが増加しています。
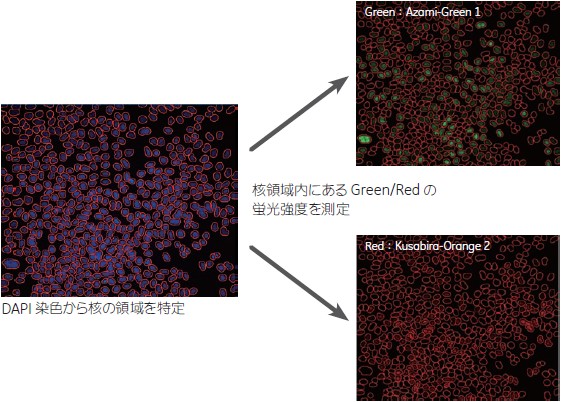
図3 画像解析の方法
DAPI 染色よりすべての核を認識しその領域を特定しました。核領域の Azami-Green1 シグナルKusabira-Orange2 シグナルを測定しました。
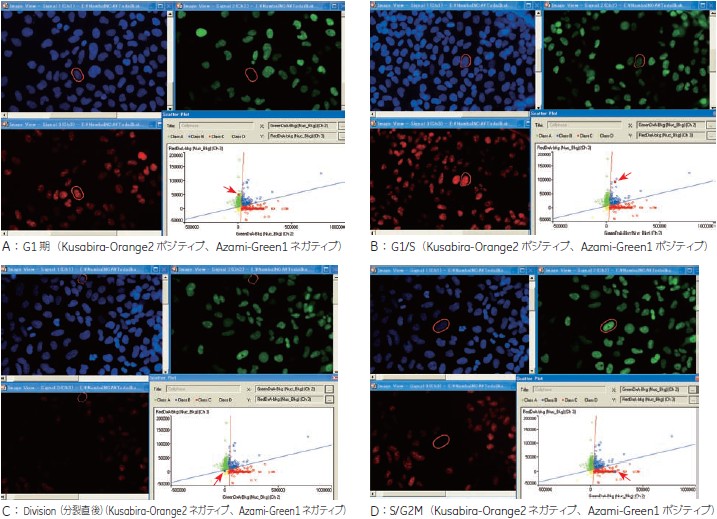
図4 Azami-Green1 シグナル、Kusabira-Orange2 シグナルの 2D Plot
横軸に Azami-Green1 シグナル、縦軸に Kusabira-Orange2 シグナルをとり 2D Plot を作成し、閾値を設定して4 群にわけました(各右下グラフ)。プロットをクリック(矢印)すると対応する細胞の画像が表示されます。
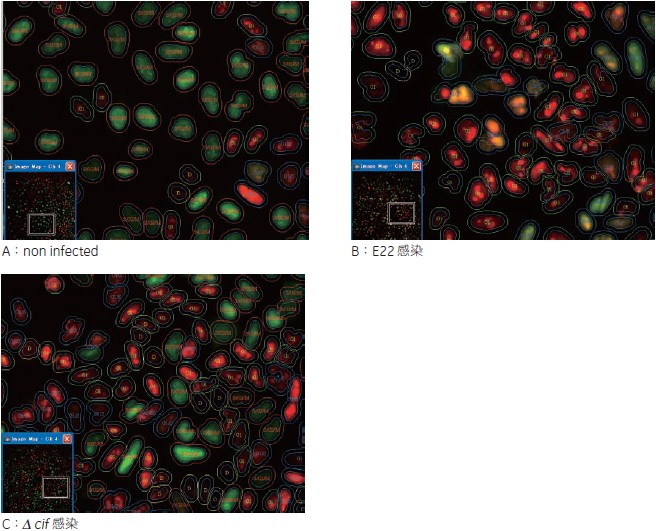
図5 各細胞の細胞周期の phase
解析後はそれぞれの細胞にどの細胞周期の phase にあたるかマーカーを表示することができます。
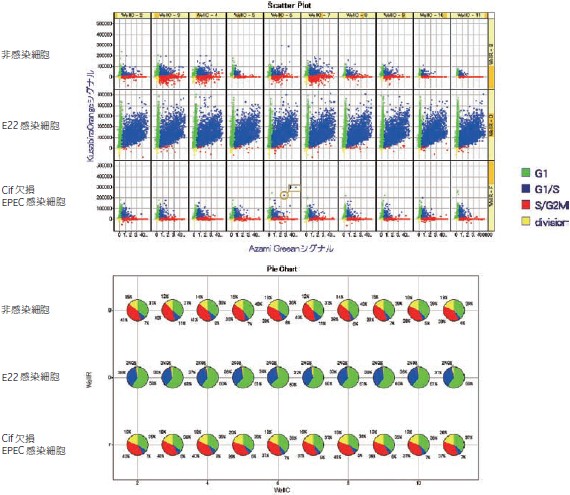
図6 各 well での各細胞周期の割合をグラフ化
EPEC 感染下ではオレンジ色の細胞(G1)が多いことが分かります。また、非感染の細胞、Cif 欠損株を感染させたものは緑色の細胞(S/G2/M)が多いことが分かります。さらにソフトウェアで自動的に細胞を認識、蛍光値を数値化しグラフ化した下図でもG1 細胞が多く、G1 期で停止していることが分かります。
まとめ
- EPEC 感染下の細胞周期の進行を観察し、感染した細胞はG1 期で細胞周期が停止し、Cif タンパクが細胞周期をG1 期でアレストしていることが測定できました。
- IN Cell Analyzer 2000 を使用してFucci 導入細胞の細胞周期の解析ができ、それぞれの細胞周期の割合を測定することができました。
参考文献
Hanako Morikawa , Minsoo Kim , Hitomi Mimuro , Claire Punginelli , Tomohiro Koyama ,
Shinya Nagai , Atsushi Miyawaki , Kazuhiro Iwai , Chihiro Sasakawa
The bacterial effector Cif interferes with SCF ubiquitin ligase function by inhibiting deneddylation of Cullin1
Biochemical and Biophysical Research Communications 401 (2010) 268-274
Sakaue-Sawano A , Kurokawa H , Morimura T , Hanyu A , Hama H , Osawa H , Kashiwagi S , Fukami K , Miyata T , Miyoshi H , Imamura T , Ogawa M , Masai H , Miyawaki A. Visualizing spatiotemporal dynamics of multicellular cell-cycle progression. Cell. 2008 Feb 8;132(3):487-98
データご提供
東京大学 医科学研究所 感染症国際研究センター
金 玟秀 先生, 森川 華子 様







