
印刷用PDF
幹細胞を用いたフローサイトメーターおよびIN Cell Analyzer 2000 によるHigh Content Analysis の比較
はじめに
IN Cell Analyzer 2000は、生細胞および固定したサンプルの高解像度かつ迅速なイメージングおよび解析に対応するベンチトップ型システムです。2~100倍の対物レンズが使用可能で、さまざまな細胞のアプリケーションにフレキシブルに対応します(1)。解析ソフトウェアIN Cell Investigatorもハイスループット・イメージングに対応し、Spotfire DecisionSite™上に表示した、マルチパラメータの解析結果と画像をリンクさせた状態で、視覚的に確認することができます。IN Cell Investigatorでは決定木(decision tree)によるデータの分類が可能で、解析によってアノテーションを付加することができます。Spotfire DecisionSite™では、これに基づいてグラフを作成し、データを可視化できます。本稿では、ヒト胚性幹細胞(hESC)から心筋細胞までの分化の過程を、High Content Analysis(HCA)法およびフローサイトメトリー法で解析し、結果を比較しました。
実験方法
独自の手法によってH7ヒト胚性幹細胞から分化誘導した後、凍結保存された心筋細胞を2,500および80,000細胞/ウェルとなるよう96ウェルプレートに播種しました。細胞は固定後、特異抗体を用いた免疫組織化学的手法により検出しました。抗体は次のものを使用しました。抗α - アクチニン抗体、抗トロポニンI抗体、抗GATA-4抗体、二次抗体としてフルオルセイン標識二次抗体(GATA-4)、Cy5標識二次抗体(α - アクチニン、トロポニンI)を用いました。核内のDNAは、Hoechst™を用いて染色し、IN Cell Analyzer 2000によって2倍対物レンズ、10対物倍レンズを用いて撮影した後、HCA 法による解析を行いました。
これと並行して、細胞をトリプシン処理し、フローサイトメーター(FACSCalibur)による測定も行いました。IN Cell Analyzer 2000による撮影画像は、IN Cell Investigator
Developer Toolboxを用いてカスタムメイドのプロトコールを作成して解析を行い、マーカーの蛍光強度に加えて、DNAの位置、形態に関する情報を導き出しました。解析データは、Developer Toolbox からSpotfire DecisionSite™ へダイナミックリンクを介してエクスポートして可視化し、各種グラフを作成しました。
結果
hESCから分化誘導した細胞は、HCA法およびフローサイトメトリー法によって解析し、α - アクチニンの発現を指標に心筋細胞に分化した細胞をカウントしました(図1、図2)。IN Cell Analyzer 2000による撮影では、細胞をトリプシン処理により剥離する必要がないため、細胞本来の状態での観察が可能であり、フローサイトメトリー法と比較して、実験上の手間を大きく省くことができます。α -アクチニンの発現量を比較すると、IN Cell Analyzer 2000を用いたHCA法による解析結果と比べて、フローサイトメトリー法の方がα - アクチニン陽性細胞の割合は低くなりました。原因として、フローサイトメトリー法では染色中に起きる細胞のロスなどによって、α - アクチニン陽性細胞を示す値が低くなったものと推測されます。この現象のさらなる検証と、IN Cell Analyzer 2000を使用した幹細胞分化のアプリケーションの有用性を評価するため、マルチパラメータ解析結果、グラフデータ、高解像度画像がリンクするHCA ワークフローを構築しました。
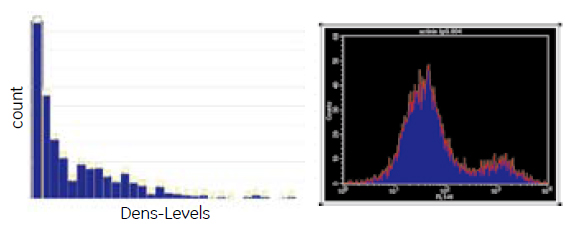
図1 幹細胞の心筋細胞への分化の解析
hESC より分化誘導した心筋細胞を評価するため、α - アクチニンを染色し、IN Cell Analyzer 2000(左)およびフローサイトメーター(右)で測定を行いました。HCA解析においては20.7%の細胞がアクチニン陽性との結果が得られたのに対し、フローサイトメトリー法では15.5%の細胞がアクチニン陽性との結果が得られました。
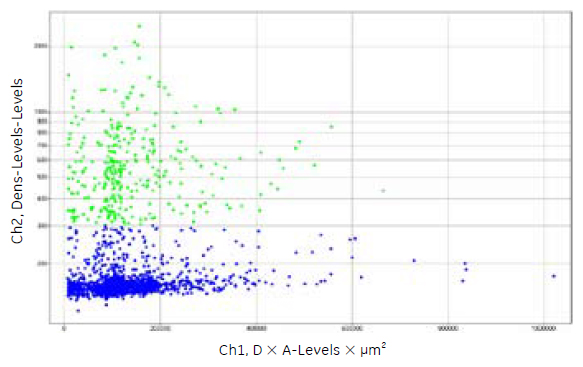
図2 hESCを分化誘導した心筋細胞におけるα - アクチニンの発現
図1 で示したデータを、Spotfire DecisionSite™によりスキャッター・プロット表示しました。α - アクチニン陽性細胞は緑色のドットで示しました。
2倍の対物レンズによる画像撮影(図3)によりウェル内における細胞の分布を観察し、10倍対物レンズによる撮影およびフェノタイプ解析を行うエリアを決定しました。Developerによってα - アクチニン、トロポニン I、GATA-4陽性細胞を分類し(図4)、各マーカーの陽性/陰性判定を行いました(トロポニン I についてはデータ非掲載)。Developer(画像と解析データ)とSpotfire™(グラフ)のダイナミックリンクによってフェノタイプに基づく分類の結果を、視覚的に確認することが可能になりました。
Developerによる決定木を用いた解析によって細胞を4つのフェノタイプクラスに分類し、その分布はSpotfire™上で自動的に可視化しました(図5)。

図3 IN Cell Analyzer 2000によるホール・ウェル・イメージング
96ウェルプレートに異なる密度で播種された心筋細胞は、固定後にα - アクチニン染色を行い、2倍対物レンズを用いてIN Cell Analyzer 2000のラージCCDカメラシステムにより撮影しました。
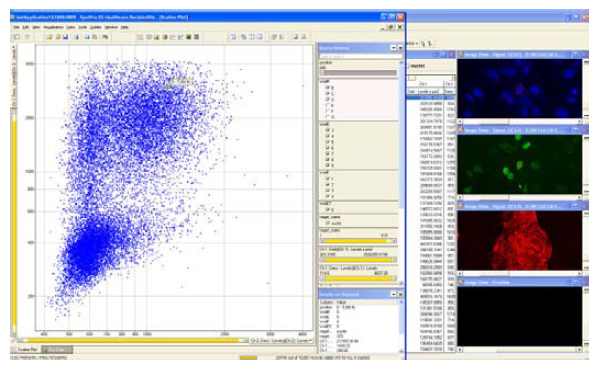
図4 画像とプロットのリンク
心筋細胞は抗α - アクチニン抗体、抗GATA-4抗体を用いた染色の後、IN Cell Analyzer 2000で10倍対物レンズを使用して撮影し、IN Cell Investigatorによる解析後、データをSpotfire DecisionSite™にて可視化しました。ダイナミックリンクによってSpotfire™によるプロット(左)と、IN Cell Investigator Developer Toolbox(右)の照合が容易になります。図中の矢印で示したのは、α - アクチニン陽性/GATA-4陽性細胞の一例で、画像、数値データ、プロット上の情報が全てリンクした形で表示されます。
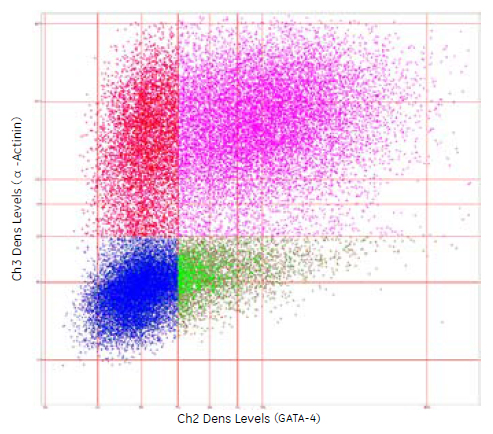
図5 α - アクチニンとGATA-4の発現
IN Cell Investigator Developer Toolboxを用いた決定木による解析は、分類後Spotfire™へデータを直接エクスポートしました。
●α -Actinin(+)陽性/GATA-4(+)陽性
●α -Actinin(+)陽性/GATA-4(-)陰性
●α -Actinin(-)陰性/GATA-4(+)陽性
●α -Actinin(-)陰性/GATA-4(-)陰性
さらなる確認のために、Developerを用いた解析から核の位置情報を取得し、Spotfire™により特定したフェノタイプのイメージマップを可視化しました(図6)。位置情報および形態測定学的なデータは、細胞のフェノタイプクラスの特定を可能にし、これはHCA法のフローサイトメトリー法に対する有利な点といえます。細胞密度を変えた場合のα - アクチニンとGATA-4の発現のフェノタイプおよび分布の情報によって、細胞密度を変えた場合にも4種類のフェノタイプすべてが存在していることが明らかになりました。これに対して各フェノタイプの相対的な出現頻度は、細胞密度によって変化することが判明しました(図7)
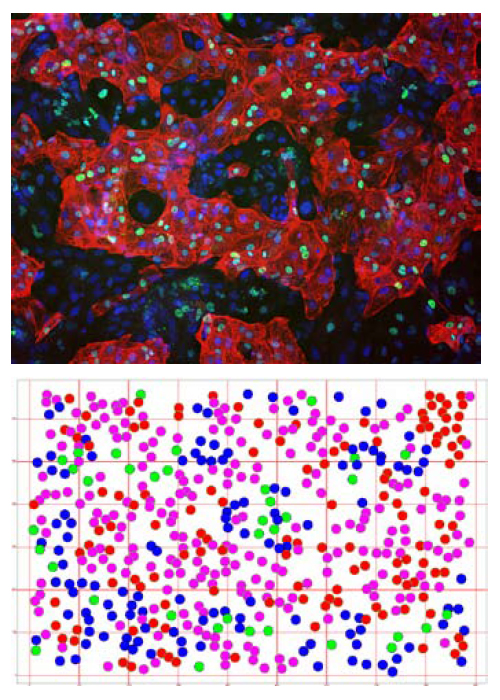
図6 Spotfire DecisionSite™によるイメージマップの可視化
上図:ヒト幹細胞由来の心筋細胞のDNA(青)、α - アクチニン(赤)を染色し、IN Cell Analyzer 2000による撮影を行いました。
下図:α - アクチニンの染色、GATA-4の染色を行った細胞のフェノタイプに基づく分類の結果を示しました。
●α -Actinin(+)/GATA-4(+)
●α -Actinin(+)/GATA-4(-)
●α -Actinin(-)/GATA-4(+)
●α -Actinin(-)/GATA-4(-)
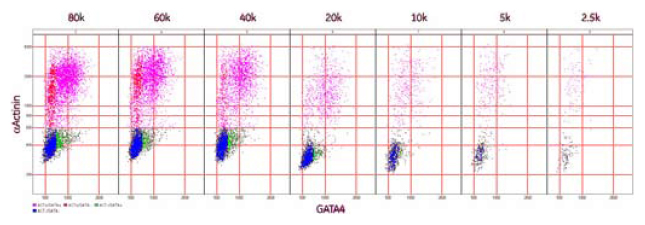
図7 マーカー発現における細胞密度の影響
細胞密度2,500~80,000個/ウェルの条件で細胞を96ウェルプレートに播種し、α - アクチンとGATA-4の発現における細胞密度の影響について検討しました。
Developerによる決定木の分類の結果はSpotfire™で可視化しました(図8)。40,000細胞および20,000細胞の密度で播種したウェルにおいて、α - アクチニン陽性細胞の減少が見られました。
α - アクチニン、GATA-4の発現量で分類される4種のフェノタイプは、細胞周期の分布と同様の結果となるか、また細胞密度が結果に影響するか否かを確認するために、DNA染色の蛍光強度に関するデータをSpotfire™にエクスポートし、可視化しました(図9)。
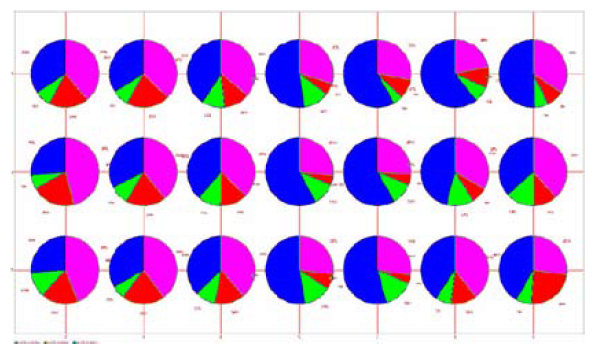
図8 各種マーカーの発現における細胞密度の影響の解析結果
細胞の分類はIN Cell Investigator Developer Toolboxを用いて行い、細胞密度を2,500~80,000細胞/ウェルの間で変えた際の各フェノタイプの存在比率を示しました。
●α -Actinin(+)/GATA-4(+)
●α -Actinin(+)/GATA-4(-)
●α -Actinin(-)/GATA-4(+)
●α -Actinin(-)/GATA-4(-)
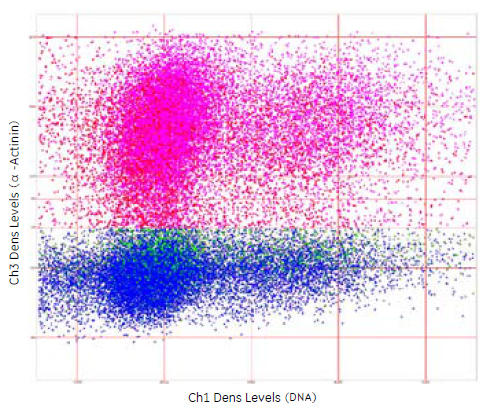
図9 細胞周期解析の結果
DNA染色の蛍光強度(X軸)とα - アクチニンの発現量(Y軸)のプロットを示しました。ドットの色は、Developerの決定木による分類に基づくものです。
●α -Actinin(+)/GATA-4(+)
●α -Actinin(+)/GATA-4(-)
●α -Actinin(-)/GATA-4(+)
●α -Actinin(-)/GATA-4(-)
各フェノタイプの細胞のDNA量に関するデータを見ると(図10)、ヒストグラムの分布はそれぞれ細胞周期のプロファイルと近似することが明らかになりました。ウェルあたりの細胞数を40,000細胞および20,000細胞にした場合の細胞周期のデータには、違いはありませんでした(図11)。形態に関する数値を検討したところ、細胞密度に依存的な違いは検出できませんでした(データ非掲載)。
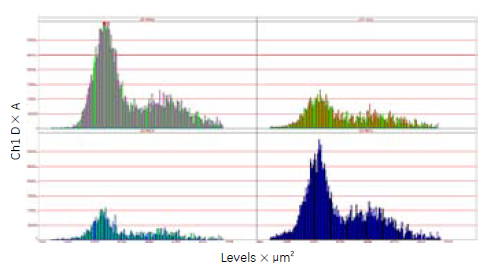
図10 細胞周期解析の結果
各ヒストグラムは、各分類によるフェノタイプ別のDNA含量のプロットを示しました。
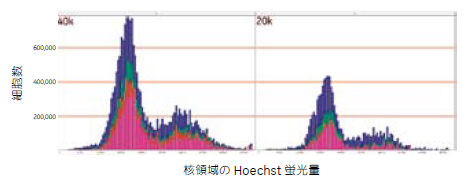
図11 細胞周期解析の結果
細胞密度が40,000細胞/ウェル(左)および20,000細胞/ウェル(右)の細胞周期の解析結果。
●α -Actinin(+)/GATA-4(+)
●α -Actinin(+)/GATA-4(-)
●α -Actinin(-)/GATA-4(+)
●α -Actinin(-)/GATA-4(-)
まとめ
- IN Cell Analyzer 2000ハイ・コンテント・イメージング・システムは、短時間で96ウェルプレートの撮影からマーカー発現の解析まで対応します。
- IN Cell Investigator Developer ToolboxとSpotfire decisionSiteのリンクによって、細胞周期とフェノタイプの分類を組合せたマルチパラメータ解析結果を、迅速かつ効果的に可視化できます。
- HCAは柔軟かつ効果的なアプローチが可能であり、フローサイトメトリー法にはない細胞の位置や形態情報に基づく解析を行うことができます。
リファレンス
- Thomas N., High-content screening: a decade of evolution. 2010; J Biomol Screen. (1):1-9.












