
印刷用PDF
IN Cell Analyzer 2000と心筋細胞を使用した薬剤候補化合物の安全性評価
毒性のある化合物が新薬開発のプロセスの後期段階で検出されることは、新薬開発のコストを増やし、開発までに長時間を費やす結果をもたらします。また、製品発売の直前で副作用が発見されると、患者への健康リスクを発生させます。そのためin vitro の実験系で副作用を予測できれば、コスト・時間の節約につながります。
このようなニーズに応えるため、ヒトES細胞からの分化誘導によって得られた心筋細胞を用い、心毒性のある化合物、もしくは心毒性の疑いのある化合物の安全性評価のためのアッセイ系を構築しました。
ここで示す心筋細胞および、イメージングサイトメーター、IN Cell Analyzer 2000を用いた毒性試験方法は、High-Content Analysis(HCA)法と呼ばれるアプローチ法で、細胞の顕微鏡画像から、より多くの情報を得ることが可能で、心毒性のある化合物の検出に有用です。
はじめに
遺伝的に安定なヒトES細胞から心筋細胞を分化誘導しました。
電気生理学的に機能性評価を行い、フローサイトメーターおよびイメージング手法によって分化していることを確認しました(1)。
凍結保存したチューブから起こした心筋細胞は、筋収縮を起こす単一細胞層を形成し、心筋に特異的な構造タンパク質やイオンチャネル(2)を発現していることを確認しました(図1)。
心毒性を示す化合物は、さまざまなパスウェイでミトコンドリア呼吸阻害、細胞膜透過性を変化させ、細胞死に至るといった細胞の形態変化をもたらします。HCA 法によるアプローチはこういった毒性に関する複数のパラメーターを同時にモニターすることが可能で、従来法である電気生理学的手法と比較すると高感度かつ効率的な毒性評価法といえます。
化合物を投与した心筋細胞は細胞膜透過性指示薬、カルシウム透過性指示薬、核染色試薬、ミトコンドリア、細胞膜透過性/バイアビリティー指示薬によって染色後、数値化し、評価しました。
さらに化合物の濃度を変え、レプリケートウェルを作成し、50種類以上のパラメーターを数値化する毒性予測法を確立しました。
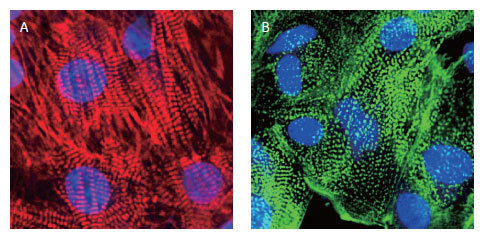
図1 心筋マーカーを発現している心筋細胞の画像。
トロポンニン I(A)およびa- アクチニン(B)の免疫組織染色の結果。
いずれもHoechst™ 33342を用いて核染色を行いました(青)。
実験内容
図2に示したワークフローに従い、アッセイプレートの準備、撮影を行いました。心筋細胞はマトリゲルでコーティングされたプレートに播種し、プロトコール(28980586AA)にそって細胞を培養しました。化合物への暴露後、心筋細胞は生細胞のままIN Cell Analyzer 2000にて撮影しました。撮影条件は次の通りです。
画像解析には、IN Cell Investigator softwareを用いました。
クラスター解析、折れ線グラフの作成、スキャッタープロットの作成にはSpotfire DecisionSite™(Tibco Software Inc., Palo Alto, CA)を使用しました。
| 蛍光色素 |
励起 |
蛍光 |
用途 |
|---|
| Hoechst™ 33342 |
490/20x |
525/20 m |
核染色 |
| Fluo-4 AM |
490/20x |
525/20 m |
細胞内カルシウム指示薬 |
| TMRM |
579/34x |
624/40 m |
ミトコンドリア膜電位指示薬 |
| TOTO-3 |
645/30x |
705/72 m |
バイアビリティー/細胞膜透過性指示薬 |
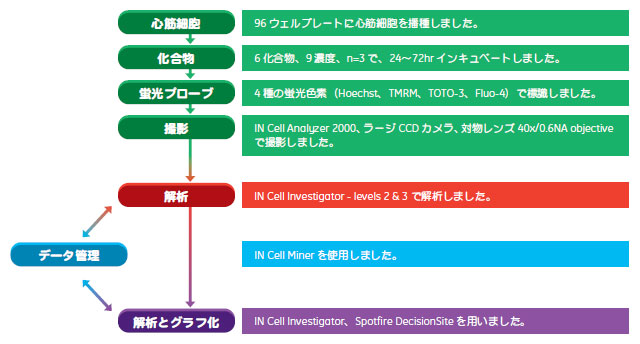
図2 アッセイのワークフロー
心筋細胞は6 種類の化合物で処理し、撮影を行った後、ソフトウェアにて解析を行いました。
結果と考察
ドーズレスポンス解析
今回、6種類の化合物の心筋細胞の機能、ミトコンドリア膜電位やバイアビリティーへの影響をモニターしました。過去の報告に基づいて、いくつかの化合物は急性毒性の評価を行い、その他の化合物に関しては、長時間にわたる変化のモニタリングを行いました。抗ガン剤として用いられ、急性心筋毒性をもたらすことで知られる化合物であるドキソルビシン(Doxorubicin)は、FDAによって最も注意を喚起するレベルの副作用(Black Box Warning)として報告されています。またドキソルビシン同様、アミオダロンは循環器系への毒性が理由で、FDAによってBlack Box Warningとして報告されています。図3に示すように、これらの化合物で処理した細胞には明らかな表現系の変化が見られました。
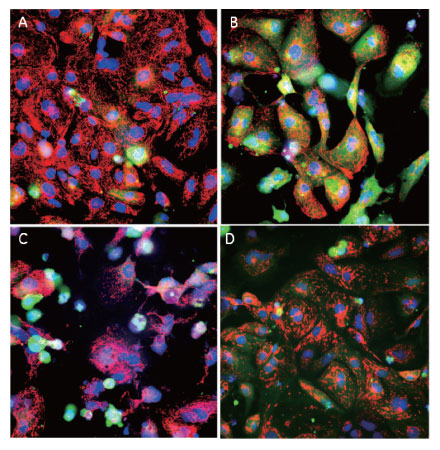
図3 マルチプレックス細胞毒性アッセイにおいて細胞に見られた明らかな表現系の変化。
A)0.5 % DMSO、B)アミオダロン、C)ドキソルビシン、D)アンチマイシンA で処理した心筋細胞を、ミトコンドリア膜電位指示薬(TMRM、赤)、カルシウム指示薬(Fluo-4 AM、緑)DNA /核染色試薬(Hoechst™ 33342、青)、バイアビリティー/細胞膜透過性指示薬(TOTO-3 iodide、非掲載)により染色しました。
画像はIN Cell Analyzer 2000で撮影しました。A(陰性コントロール)と比較して、B(アミオダロン処理)ではカルシウム透過性、ミトコンドリアの形態が大きく変化しています。C(ドキソルビシン処理)ではカルシウム透過性・ミトコンドリアの形態だけでなく、核の形状が変化しています。この変化はアミオダロン処理の場合とは異なる現象です。DのアンチマイシンAで処理したものでは、最も大きな表現系の変化がみられました。以上のように、心筋細胞を各薬剤で処理したところ、それぞれ異なる形態変化が観察されました。
このように細胞の形態に基づくマルチパラメーター解析によるプロファイリングは、薬剤毒性の予測に非常に有用であることがわかります。
ドーズレスポンス曲線を図4に示しました。アミオダロンとドキソルビシンは今回のアッセイにおいて、過去に報告されているようなミトコンドリアの形態(真円率)と細胞膜透過性に濃度依存的な影響が検出されました。また、核面積の変化や、細胞内カルシウム濃度にも変化が見られました(データー非掲載)。半数以上の細胞の細胞膜の構造変化をもたらす薬剤濃度(Toxic Dose 50; TD50)は、ドキソルビシンが1.6μM、アミオダロンが4.5μM でした。この濃度は、他の手法を用いた際の知見に一致するものでした(3)。これらの化合物への応答は、類似した傾向が見られましたが、得られた画像とドーズレスポンス曲線は異なる薬力学的作用を示唆するものでした。アポトーシス誘発因子であるBax は、ミトコンドリアの膨化を引き起こすことが知られています。
今回得られた結果から、ドキソルビシンの急性毒性はBaxを介するものであり、アミオダロンはこれを介さないことが示唆されました。
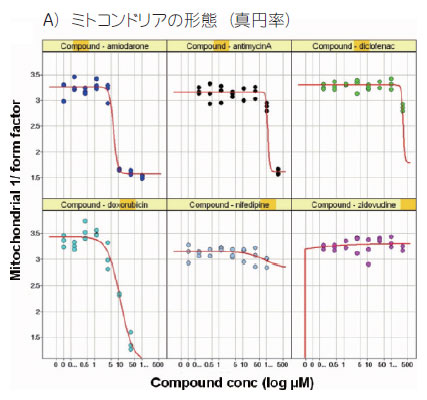
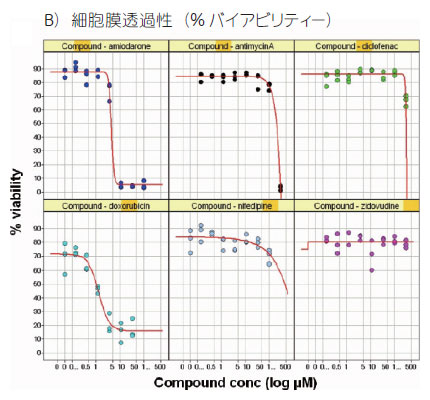
図4 マルチパラメーター解析により明らかになる各種化合物への反応
それぞれのプロットは、Spotfire DecisionSite™ を用いて作成しました。A)ミトコンドリアの形態(真円率)、B)細胞膜透過性(%バイアビリティー)を6種類の化合物についてプロットしました。心筋細胞は、24~72時間それぞれの化合物に暴露し、得られたデーターは非線形回帰分析を行いました(n=3ウェル)。
アミオダロン(amiodarone)、ドキソルビシン(doxorubicin)において濃度の上昇にともないミトコンドリアの形態変化および細胞膜透過性に変化が見られました。
プロファイリングの方法
今回のデーターが示すように、細胞のイメージングによる手法は、潜在的な毒性予測に限らず、応答の類似性に基づいて心毒性を示す化合物を分類できます。4色の蛍光を使用したHCA法は、細胞毎の数値が得られかつ情報量が多いため古典的な手法に比べて有利だといえます。多くの細胞の解析データーに基く各化合物のプロファイリングは強力なツールであり、化合物が示す異なる作用の評価を高感度に行えます(5)。今回示したHCA 法によるアプローチでは、各画像の全細胞に関して54種の異なるパラメーターを数値化しました。できる限り多くの情報を得るために、画像のパターン認識を行った後、自動解析を行い、結果を可視化しました。各化合物に関するデータは、クラスター解析を行い、ヒートマップを作成しました。図5 Aに示すヒートマップ上の各列は、それぞれの実験条件内でノーマライゼーションを行った結果です。ヒートマップによって、異なる濃度の同一化合物が類似した傾向を示すことが明らかになりました。マルチパラメーターの組合せは、薬剤ごとに異なるパスウェイを介した毒性を反映する結果でした。
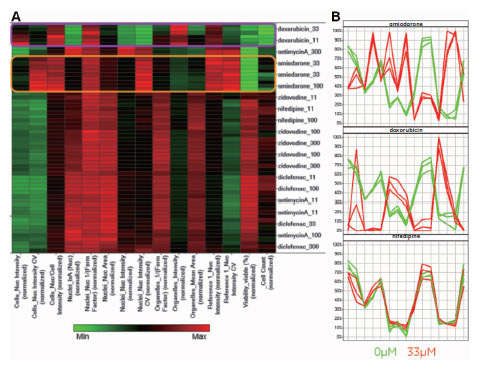
図5 階層的クラスター解析とプロファイルツールによる解析結果
A)6種の化合物、濃度が高いものから4 番目までの濃度系列、13種類のパラメーター解析の階層的クラスター解析結果を示しました。蛍光色素はFluo-4 AM( カルシウム指示薬)、 Hoechst™ 33342( 核染色試薬)、 TMRM(ミトコンドリア膜電位指示薬)、 TOTO-3 iodide(細胞膜透過性/ バイアビリティー)を使用しました。紫色の枠はドキソルビシン処理、オレンジ色はアミオダロン処理のプロファイリング結果を囲んだものです。レプリケートサンプルや異なる濃度の同一化合物(ここでは11μM および33μM のドキソルビシン、33μM および100μM のアミオダロン)は類似した傾向を示しています。
ドキソルビシンとアミオダロンは、これらの化合物を低濃度で使用した場合や他の化合物とは異なる結果を示すことから、毒性をもつと考えられます。しかし、これらの示す傾向は互いに異なることから、ぞれぞれ別の作用機序によることが示唆されました。
B)0μM(緑)から33μM(赤)のアミオダロン(上段)、ドキソルビシン(中段)、ニフェジピン(下段)の核およびミトコンドリアの形態解析の結果を表示しました。
n=3のレプリケートウェルを作成し、データを得ました。上2段はプロットが重ならないことから、表現系の変化が生じたことを示します。
図5 Bに示したグラフは各種パラメーターの解析結果の相対的値をプロットした結果です。細胞の表現系変化を理解しやすいよう、それぞれの薬剤濃度(0μM、33μM)へ応答のプロットを重ね合わせて表示しました。アミオダロンとドキソルビシンでは濃度変化(緑→赤)により、明らかに異なるプロットを示すことから、形態変化が生じたことが分かります。これとは対照的に、ニフェジピン処理では濃度変化があっても同じプロットを示すことから形態変化が生じなかったことが分かります。ドキソルビシン、アミオダロン、アンチマイシンの3化合物による試験結果は、高い濃度において顕著な形態変化を誘発しました。しかしながらジクロフェナック、ジドブジン、ニフェジピンは、DMSOを投与した陰性コントロールと類似したグラフパターンを示しました。これらの化合物は心筋細胞への有害な作用が知られていますが、今回の結果より、細胞死を引き起こすドキソルビシン、アミオダロン、アンチマイシンAよりも急性度の低い細胞毒性であることが示唆されました。
自動プロファイリング
今回、プロファイリングにより、化合物の毒性を特定するための指標となるパラメーターを選択しました。これらの重要なパラメーターによって、化合物投与後の形態変化による毒性の自動判定を行いました(図6)。アミオダロン、ドキソルビシン、アンチマイシンAによる形態変化が顕著であった濃度を赤色で示しました。ドーズレスポンス試験においては、薬剤の残留による影響が無いよう留意しました。
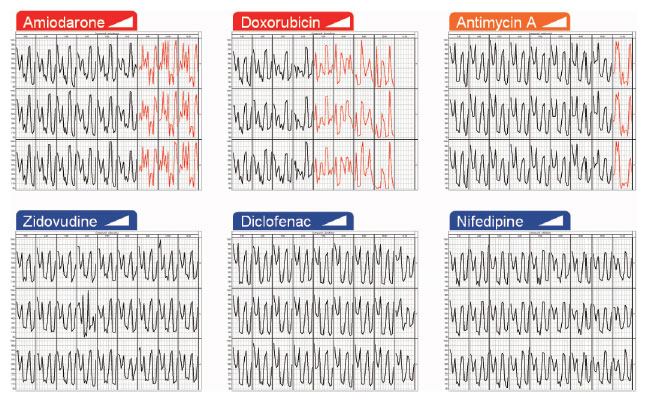
図6 自動プロファイルによる解析結果
各化合物に対する濃度依存的な形態変化のプロファイリングは、n=3 のレプリケートウェルを作成して行いました。
平均値だけでなく、ウェルごとのデータを表示できます。
結論
- 今回示した心筋細胞を用いたHCA法は、心筋細胞のライブセルアッセイに対応し、6種類の化合物の毒性評価と、毒性化合物の分類が可能でした。
- HCA法は、マルチパラメーター解析に対応し、化合物の毒性判定と分類において強力な手段です。
- パターン認識に用いた解析ソフトウェアIN Cell Investigator Software は、異なる作用機序を有する化合物を判別できることが示されました。
- 自動プロファイリングは、毒性を有する可能性のある化合物のライブラリーを作成でき、新規化合物の薬剤の影響の予測を可能にします。
References
- Product sheet: Cardiomyocytes. Relevant. Reliable. Confident. A new era in safety screening with human cell models, Cytiva, 28-9801-12, Edition AB (2010).
- Stem-Cell Derived Human Cardiomyocytes: utility for cardiac Safety Pharmacology and Detection of Complex Drug Effects.
Bruening-Wright, A. et.al. (Poster presented at the 9th Annual World Pharmaceutical Congress, June 15-17, 2010, Philadelphia, Pennsylvania
- Filigheddu, N. et al. Hexarelin protects H9c2 cardiomyocytes from doxorubicin-induced cell death. Endocrine (2001) 14:113-119.
- An, J. et al., ARC is a critical cardiomyocyte survival switch in doxorubicin cardiotoxicity. J. Mol. Med. 87, 401-410 (2009).
- Freeley, M. et. al. A high-content analysis toolbox permits dissection of diverse signaling pathways for T-lymphocyte polarization. J. Biomol. Screening (2010) 15:541-555.








