
印刷用PDF
IN Cell Analyzer 2000 を用いた明視野コロニー解析
はじめに
限界希釈法による細胞クローニングや細胞増殖アッセイにおいては、非染色系でのコロニーカウントや細胞の接着面積の測定などが求められます。
イメージングサイトメーターIN Cell Analyzer 2000は2048×2048ピクセルの大型CCDカメラの搭載により、96ウェルプレートにおいて2×レンズでは1視野、4×レンズでは4視野撮影でホールウェル撮影が可能です。それにより、ウェル内のすべてのコロニーを対象に、迅速な自動解析が可能になりました。
今回、CHO-K1およびHEK293の二種類の細胞株を用いて、非染色系のコロニー解析を試みました。
実験方法
使用した製品
- IN Cell Analyzer 2000
- IN Cell Investigator Software - Developer toolbox
サンプルおよび試薬
- CHO-K1細胞
- HEK293細胞
- Corning™ CellBIND 96 Well Clear Flat Bottom Polystyrene Microplate, with Lid, Sterile(カタログ番号:3300)
方法
1枚の96ウェルプレートのうち左半面にCHO-K1細胞を、右半面にHEK293細胞を、それぞれ1,000細胞および8,000細胞から1/2希釈をしながら4ウェルずつ播種しました(図1)。その後、毎日1回インキュベーターからプレートを取り出し、コロニーの様子をIN Cell Analyzer 2000を用いて透過光撮影しました。撮影は、プレートの蓋を閉じたまま4×レンズを用いて行い、各ウェル4視野ずつ画像を取り込むことでウェル全体がカバーできます。また、2×2ビニングで解像度を半分に落として、通常の明視野のほか、2D-Deconvolution mode を用いた明視野画像の取得も行いました。
培養4日目に、コロニー形成が確認されたところで、IN Cell Investigator Softwareにより4視野の画像をスティッチングで1枚のホールウェル画像とし、そこからコロニーの数およびサイズの計測を行いました。
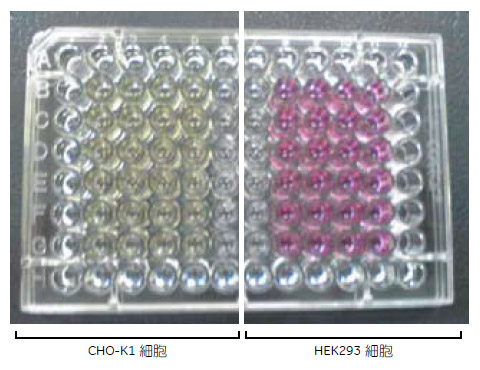
図1 CHO-K1細胞およびHEK293細胞を播種した96ウェルプレート
結果

図2 CHO-K1細胞のコロニー形成の様子
1ウェルあたりおよそ63細胞が播種されたウェルのコロニー形成の様子。毎日1度IN Cell Analyzer 2000により明視野撮影を行いました。
A)播種後1日目 B)播種後2日目 C)播種後3日目 D)播種後4日目
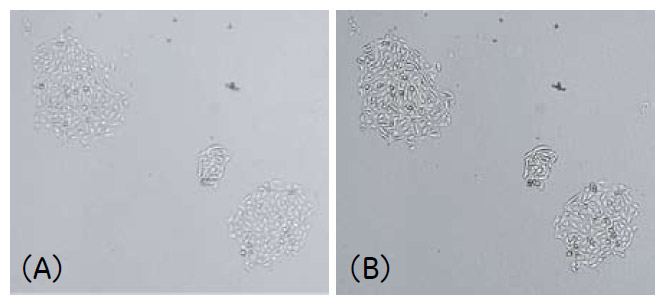
図3 撮影モードによる画像の違い
2×2ビニングにより解像度を半減させた4×レンズによるCHO-K1細胞の明視野画像。
(A)通常の明視野 (B)2D-Deconvolution modeを用いた明視野画像
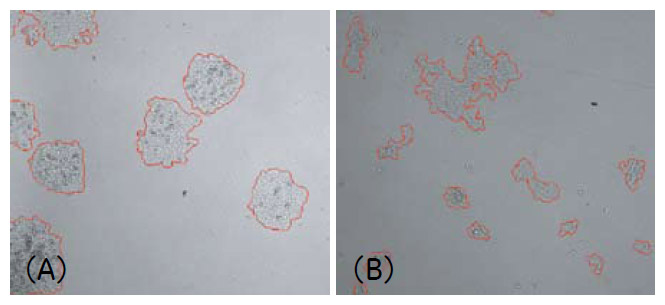
図4 IN Cell Investigator Softwareによるコロニー認識の様子
播種後4 日目の撮影画像をIN Cell Investigatorにより解析を行いました。
(A)CHO-K1 細胞 (B)HEK293 細胞
IN Cell Analyzer 2000は、400万画素のlarge-chip CCDカメラが搭載可能です。96ウェルプレートであれば、4×レンズで4視野、2×レンズで1視野撮影することでホールウェル撮影ができ、コロニーを対象としたアッセイに最適です。
今回、CHO-K1およびHEK293の二種類の細胞株を用いて、非染色系のコロニー解析を試みました。図1のようなプレートフォーマットで細胞密度の段階希釈を用意して、4日間培養しながら1日に1回IN Cell Analyzer 2000により画像取得を行いました(図2)。コロニー解析のような解像度を必要としないアッセイについては、ビニング機能によりファイルサイズを小さくすることで、より短時間に解析を行うことができます。今回、2×2ビニングで画像サイズを半減させ、撮影モードとして通常の明視野のほか2D-Deconvolution mode による撮影も試みました(図3)。
2D-Deconvolution mode では、細胞やコロニーのコントラストがより明瞭となり、解析時のコロニー認識にも改善が見られました(図4、5)。培養4日目のコロニー数および細胞接着面積を解析した結果、細胞播種数に応じた細胞増殖の様子が確認されました(図6)。
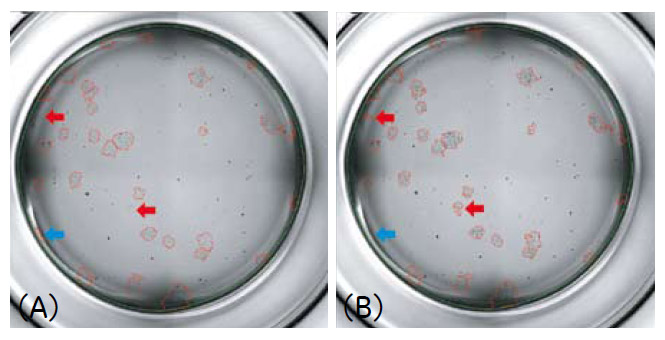
図5 撮影モードの違いによるコロニー認識の違い
播種後4日目のCHO-K1細胞撮影画像を、IN Cell Investigatorにより解析を行いました。
(A)2D mode(通常の明視野)
(B)2D-Deconvolution mode
(赤矢印)2D-Deconvolution modeにより検出が改善されたコロニー
(青矢印)2D-Deconvolution modeにより検出されなくなったノイズ
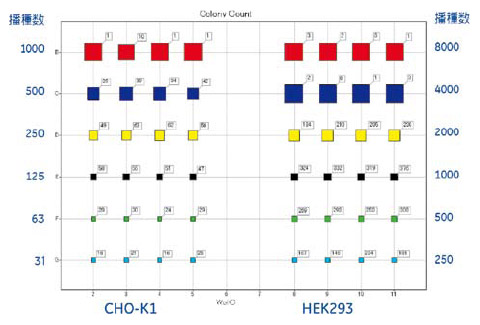
図6 培養4日目における細胞数およびコロニー数
培養4日目の撮影画像からコロニー解析を実施しました。ウェルポジション上の四角の大きさは、細胞接着面積を示しています。また四角に付けられたアノテーションはコロニー数を示します。
まとめ
- 明視野撮影による接着細胞のコロニー解析が可能であることが示されました。限界希釈法による細胞クローニングや細胞増殖アッセイが可能であると考えられます。
- Large Chip CCDカメラにより、4×レンズあっても4視野で96プレートのホールウェル撮影が可能です。
- ビニング機能によりファイルサイズを下げることで、より迅速な解析が可能になります。
- 2D-Deconvolution mode を用いることでコロニーのコントラストが鮮明になり解析精度が向上します。
※ IN Cell Analyzer 2000は2013年2月をもちまして販売終了しております。後継機種IN Cell Analyzer 2200でも、同様の解析を行うことができます。







