|
||
|---|---|---|
|
|
||
|
Location:Home > 実験手法別製品・技術情報 > ウェスタンブロッティング |
||
Amersham™ ECL™ Gel 水平型電気泳動システムAmersham™ ECL™ GelおよびAmersham™ ECL™ Gel Boxは、タンパク質用の水平型ミニゲル電気泳動システムです。ゲルは標準Laemmli(Tris-Glycine)バッファーとの併用が可能で、品質保証期間が製造より12ヵ月と長くなっています。Amersham™ ECL™ Gelはサンプルを、再現性よく分離し、標準的なタンパク質検出プロトコールで十分な機能を発揮します。タンパク質をこのゲルから高い効率で転写できるため、Amersham™ ECL™ウェスタンブロッティングのワークフローに組み込むと便利です。
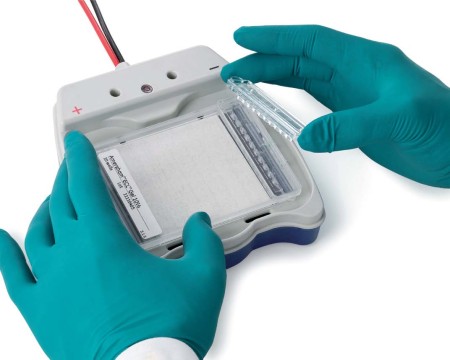
Amersham™ ECL™ Gelシステム(図1)は使いやすい設計になっています。水平型なのでサンプルを添加しやすく、バッファーは少量ですみ、バッファーチャンバー間の漏れリスクがありません。自作ゲルとは異なり、Amersham™ ECL™ Gelは再現性が高く、調製に必要な時間が短く、有毒なアクリルアミドへの曝露を避けられます。
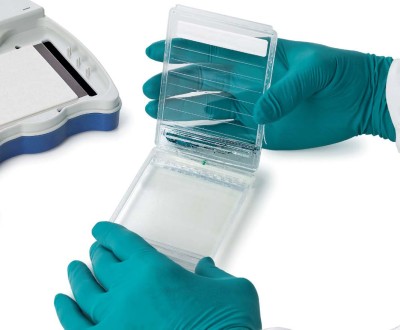
Amersham™ ECL™ Gelには、15、10、2ウェル型のホモジニアスゲル(10%、12%)とグラジエントGel(4 ~ 12%、8 ~ 16%、4 ~ 20%)があります。SDS-PAGE用の10倍濃縮泳動バッファーのほか、ウェスタンブロッティングに使用するプレカットしたHybond™メンブレンもご用意しています。 サンプルの適用とゲルの取り扱いが容易Amersham™ ECL™ Gelシステムは、アガロースゲルDNA電気泳動と同等の使いやすさでPAGEを行える設計となっています(図2)。 電気泳動後の処理を行うために、ゲルをゲルカセットから簡単に取り外せます。Amersham™ ECL™ Gelの厚さは他の多くのプレキャストゲルや自作ゲルよりも若干厚い1.4 mmですので、取り扱いが簡単で、ゲルが壊れるリスクが低く、流動後の処理に便利です。このゲル厚により、予備電気泳動で添加できるサンプル量も増え、2ウェルゲルではウェル当たり最大100 µlです。
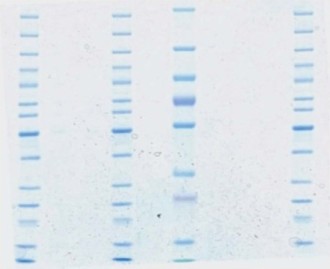
ゲルの性能:高い品質保証期間Amersham™ ECL™ Gelは、製造から12ヵ月間品質を維持しています。図3に示すように、保存期間にかかわらず一貫した結果が得られます。
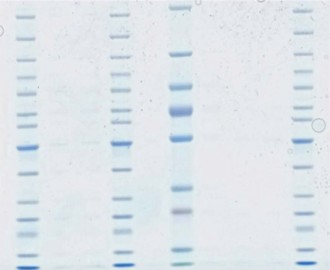
A ゲルの性能:分離能と感度PAGE後、ゲルの全タンパク質染色を行うことでタンパク質を検出できます。もっとも広く使用されている染色色素はクーマシーブルー色素ですがDeep Purple Total Protein Stainなどの蛍光染料試薬を用いると感度が向上します。
手法に合ったゲルの選択Amersham™ ECL™ Gelは、SDSを含まないプレキャストゲルです。そのため、泳動バッファーとサンプル溶解バッファーの組成を選択することで、ユーザが分離条件を選択することができます。
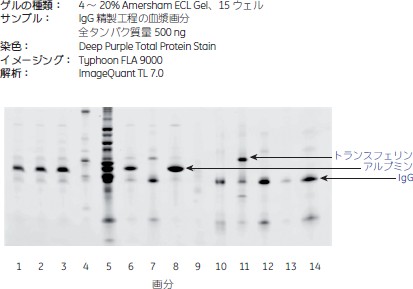
ヒト血漿から得たIgGの純度の評価液体クロマトグラフィーシステムÄKTApilot™を用いたヒト血漿由来IgG精製工程の各段階のサンプルでSDS-PAGEを行いました(図6)。PAGE後、ゲルをDeep Purple Total Protein Stainで染色しました。液体クロマトグラフィーのフラクショネーション後のタンパク質純度分析にAmersham™ ECL™ Gelが十分な分離能をもっていることが分かりました。
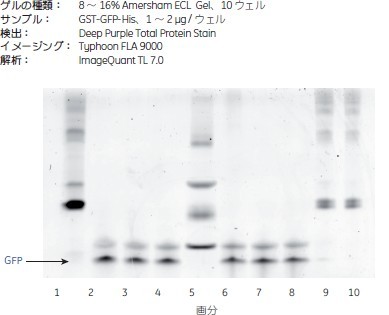
カラム内切断効率の評価この実験では、2種類のプロテアーゼの活性と切断効率を比較しました。green fluorescent proteinと結合させたGlutathione S-transferase(GST-GFP)をサンプルとして使用しました。GST-GFPをGST SpinTrap™に結合させ、数回洗浄した後、プロテアーゼAまたはプロテアーゼBを加えました。
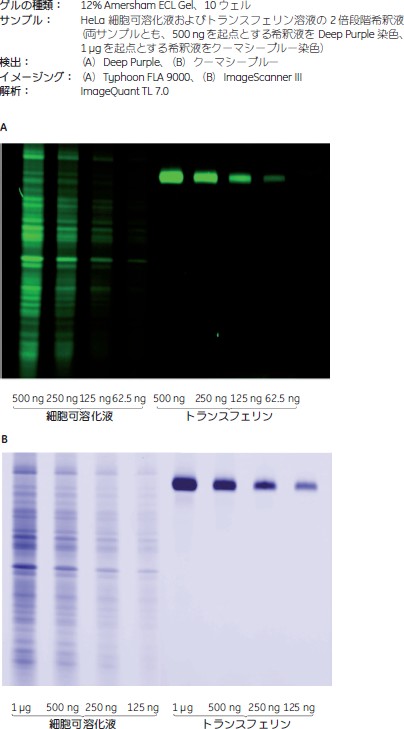
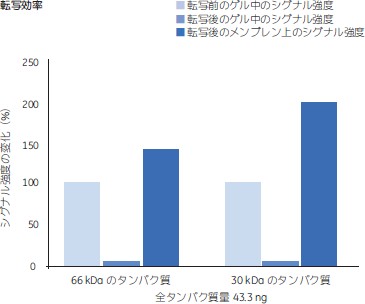
ウェスタンブロッティングとAmersham™ ECL™ GelSDS-PAGEはウェスタンブロッティング前にタンパク質を分離する方法としてもっとも広く使用されています。Amersham™ ECL™ Gelからの転写は効率が高く、一般にタンパク質量の95%程度をメンブレンに転写できます(図8)。Amersham™ ECL™ Gelを使用することで高感度のウェスタンブロッティングに適した条件が得られ、またこのゲルはAmersham™ ECL™ PrimeおよびImageQuant™ LAS 4000イメージャーの使用に合わせて至適化されています。
ウェスタンブロッティング:翻訳後修飾を定量するp38は細胞の分化とアポトーシスに関与するマイトジェン活性化タンパク質キナーゼで、リン酸化による調節を受けます。ここで、HEK 293T細胞を形質転換増殖因子-β(TGF-β)に曝露した例を示します。Amersham™ ECL™ Gelで細胞可溶化液のPAGEを行った後、ウェスタンブロッティングを行ってp38とリン酸化p38(pp38)の濃度を経時的に評価しました(図9)。ハウスキーピングタンパク質GAPDHの濃度で標準化した後、pp38の相対的定量を行いました。
p38はTGF-βによる刺激に対して30分後に反応しリン酸化しました。電気泳動の結果よりpp38のシグナルのピークが120分後にあるように見えます。しかし、GAPDHシグナルに対し標準化した結果は、pp38量のピークは120分後ではなく30分後にあることを示しています。その後、TGF-βの存在下でpp38はリン酸化された状態を保っています。 ここに示したウェスタンブロッティングの結果は、Amersham™ ECL™ Gelを使用することでタンパク質の転写と分析に最適な条件が得られ、タンパク質発現のわずかな変化や翻訳後修飾を精密に定量できることを示しています。 Ordering information
関連製品
お問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
||
© 2025 Cytiva