|
||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
||||||||||||||||||||||||||
|
Location:Home > テクニカル情報配信サービス > バイオダイレクトメール > バイオ実験の原理と方法 |
||||||||||||||||||||||||||
バイオダイレクトメール vol.29 Technical Tips
|
||||||||||||||||||||||||||
| 特性 | 精製法 | 特徴 |
|---|---|---|
| 吸着クロマトグラフィー | ||
| 生物学的親和性(特異的リガンド) | アフィニティークロマトグラフィー(AC) | 特異性が高く、ワンステップで高純度サンプルを得ることができる。 抗体精製、His-Tagタンパク質やGST融合タンパク質精製などで汎用されている。 |
| 表面電荷 | イオン交換クロマトグラフィー(IEX) | 処理量、処理スピードとも優れ、初期精製から最終精製までのすべてのステップで使用される。 |
| クロマトフォーカシング | 等電点の違いで分離する方法でイオン交換より分離能が高い。溶出には専用カラム・担体と専用バッファー(キャリアアンフォライト)を使用する。 | |
| 疎水性 | 疎水性相互作用クロマトグラフィー(HIC) | タンパク質の疎水性の強さで分離する手法。硫安分画やイオン交換クロマトグラフィーの溶出液など、高濃度の塩を含むサンプルの分離に使用され、水系のバッファーで溶出する。 |
| 逆相クロマトグラフィー(RPC) | 溶出に有機溶媒を使用するためタンパク質は失活しやすく、ペプチドの分離に適している。分離能は非常に高い。 | |
| ゲルろ過クロマトグラフィー | ||
| サイズ | ゲルろ過クロマトグラフィー(分子ふるいクロマトグラフィー)(GF) | 処理サンプル量は少ないが、自由にバッファーを選択でき、穏やかな条件での分離が可能。 脱塩、バッファー交換にも利用される。最終精製で使用されることが多い。 |
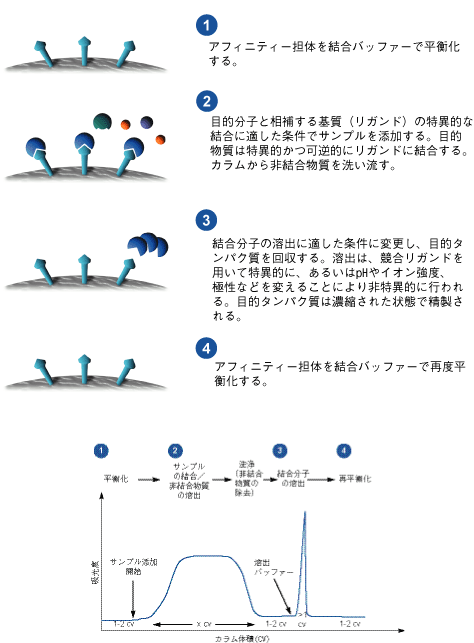
特定の分子に対して親和性を持つタンパク質の場合は、アフィニティークロマトグラフィー(図2)によりワンステップで高純度タンパク質を精製することができます。特異的な親和性をもつタグとして組換えタンパク質で一般的に使用されているのが、Glutathione S-Transferase(GST)とヒスチジンタグ(His-tag)です。目的のタンパク質をタグ融合タンパク質として発現させることにより、精製および検出が容易になります。
タグを持たない非融合タンパク質の場合には、アフィニティー精製が使用できないため、一般的なタンパク質と同様に上述の手法を組合わせて精製を行う必要があります。
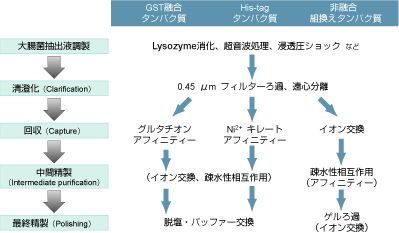
図1:組換えタンパク質精製のフローチャート
※次回のTechnical TipsではGST融合タンパク質を取り上げます。
お問合せフォーム
※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。
お問い合わせありがとうございます。
後ほど担当者よりご連絡させていただきます。
© 2026 Cytiva