バイオダイレクトメール vol.6 Technical Tips
<カタボライトリプレッションを用いた発現調節>
pGEXベクターに目的遺伝子を導入してクローニングしたとき、大腸菌のコロニーが現れない、あるいは培養液が濁らなくて困った!というご経験はないでしょうか。このようなとき、形質転換に失敗したと考え、トランスフォーメーションの条件を見直されることと思います。実は形質転換の失敗以外にもこのような現象がみられることがあるようです。目的のタンパク質が大腸菌の生育に有害な場合は大腸菌が増殖しません。設計どおりの発現ベクターが構築されていてもコロニーが得られないことになります。
発現誘導をかけるまではベクター中のリプレッサーが発現され、オペレータ部位に結合してタンパク質の発現を抑えます。しかし完全に発現が抑えられるわけではなく、基底レベルのタンパク質が発現されます。目的タンパク質が大腸菌にとって有害である場合にはこの基底レベルでも致死量になります。そのため大腸菌を増やすには基底レベルをより低くすることが解決策になります。
pGEXベクターは目的タンパク質遺伝子をクローニングするサイト(MCS)、lacプロモーター(Plac)とtacプロモーター(Ptac)、及びlacリプレッサー(lacIq)によって構成されています(図1)。
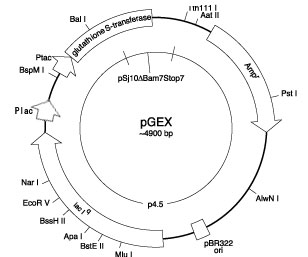
図1 pGEXベクターの構造
IPTGによる発現誘発前にはこのlacリプレッサーの作用により各々のプロモータからの転写、翻訳が抑制されます。しかし前述のように完全には抑制されず、基底レベルのタンパク質は発現されているのです。そこで培地に2%のグルコースを添加します。するとカタボライトリプレッション(図2)によってlacプロモーターからの転写が抑制されます。
tacプロモーターはグルコース濃度に左右されないので、IPTGで発現誘導をすると転写・翻訳がおこります。ただし、発現したタンパク質は大腸菌にとって有害物質なので発現誘導後はすぐに大腸菌が死んでしまいます。そのため、誘導前にできるだけ大腸菌を増やしてから発現誘導を行います。
培地に2%のグルコースを入れる方法は他のベクターのlacプロモーター下流域に毒性の高いタンパク質をクローニングするときにも使えます。その場合、IPTGとX-galでBlue/WhiteセレクションすることはできないのでIPTG(-)+2%グルコースのプレートで培養し、コロニーをピックアップした後、PCRあるいはシークエンシングによりインサートの有無を確認する必要があります。コロニーからシークエンシング用テンプレートを増幅するには、vol.4のTipsでご紹介したTempliPhi™ Amplification Kitがおすすめです。
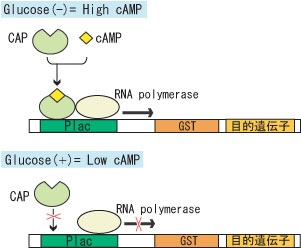
図2 カタボライトリプレッション
cAMPとCAP(Catabolite Activator Protein)の複合体が活性部位に結合するとRNAポリメラーゼがDNAに結合し、転写・翻訳がおこります(上)。グルコース存在下ではcAMPの合成が阻害されCAP+cAMP+DNA複合体ができないため、RNAポリメラーゼが転写できなくなります(下)。

