抗体精製をマスターしよう (1)
抗体の成り立ち
 抗体はライフサイエンス研究全般において必須の道具の一つで、免疫学的測定・解析をはじめとして、細胞やタンパク質の機能解析、遺伝子の発現スクリーニングなどの基礎研究においても利用されています。1975年にKöhlerとMilsteinによってモノクローナル抗体を産生するハイブリドーマ細胞株の樹立方法が確立されて以来、生命現象を個々のタンパク質レベルで研究するための最も重要なツールのひとつとして活用されてきていることは言うに及びません。さらには、昨今では近未来の医療を担う抗体医療の直接的な手段として、世界各国の製薬企業が抗体医薬品の研究開発に大きな力を注いでいます。
抗体はライフサイエンス研究全般において必須の道具の一つで、免疫学的測定・解析をはじめとして、細胞やタンパク質の機能解析、遺伝子の発現スクリーニングなどの基礎研究においても利用されています。1975年にKöhlerとMilsteinによってモノクローナル抗体を産生するハイブリドーマ細胞株の樹立方法が確立されて以来、生命現象を個々のタンパク質レベルで研究するための最も重要なツールのひとつとして活用されてきていることは言うに及びません。さらには、昨今では近未来の医療を担う抗体医療の直接的な手段として、世界各国の製薬企業が抗体医薬品の研究開発に大きな力を注いでいます。
このようにライフサイエンス研究において広く活用されている抗体ですが、動物種や使用する原料によってサンプルの前処理方法や精製方法が異なり、実験目的によって求められる純度も様々であるため、タンパク質精製を初めて行う研究者にとっては抗体の精製は必ずしも容易な操作とは言えません。
本連載では、これから抗体の精製に着手される皆さまを対象として、抗体精製の原理から、抗体の種類別精製プロトコール、サンプルごとの処置方法まで、1年間にわたってわかりやすくご紹介して参ります。
初回の今回は、抗体の精製に深く関わってくる抗体の成り立ちについてご紹介します。多種多様な抗体の構造や性質の違いを知ることで、より的確な精製ストラテジーを立てることが可能になります。
抗体の基本構造
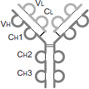
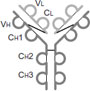
図1 免疫グロブリンの基本構造
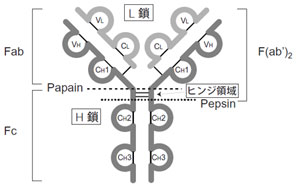
すべての免疫グロブリン(Ig)は2本の同一H鎖(Heavy chain)と2本の同一L鎖(Light chain)の計4本のポリペプチド鎖を基本構造としています(図1)。
H鎖とL鎖はY字型に配置しており、ジスルフィド結合(S-S結合)で結合しています。4本のポリペプチドにはアミノ酸配列が非常に高い類似性を示す定常部位(constant region:CH1/CH2/CH3)とアミノ酸配列の類似性が低い可変部位(variable region:VH/VL)が存在し、可変部位の先端が抗原結合部位です。
免疫グロブリンはPapainによってH鎖の中央付近で限定分解され、その際の定常部位側をFcフラグメント、可変部位を含む側をFabフラグメントと呼びます(図2)。また、Pepsinを用いて分解する場合は、Fabはヒンジ領域を含んで左右が連結した状態で消化され、これをF(ab')2フラグメントと呼びます。(この際Fcは細かく分解されます。)
図2 Fab, Fc, F(ab)2フラグメント
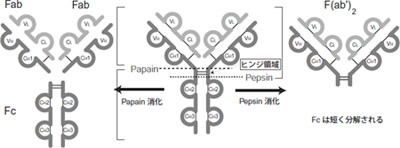
このように免疫グロブリンの基本構造が共通しているため、抗体の精製に際しては生物学的親和性を利用したアフィニティークロマトグラフィーによって精製プロセスをルーチン化することが可能です。これが抗体精製の大きな特徴のひとつです。 例えば、もっともよく用いられるIgGのアフィニティークロマトグラフィーにおいては、定常部位に対して親和性を持つリガンドであるProtein A・Protein Gを用いるのが一般的です。特にProtein Gは、対応できる動物種・サブクラスの範囲が広く、温和な条件で結合できるため、もっともよく用いられます。IgG以外の抗体についても、多段階にわたるの精製過程で、まずはじめにアフィニティークロマトグラフィーを行うのが一般的です。
抗体のクラス
以上のような構造を基本に、免疫グロブリンにはIgG、IgM、IgA、IgD、IgEの5つのクラスが存在し、それぞれが異なる構造を持ち、異なる免疫機能を担っています。
IgG、IgD、IgEの3つのクラスは基本構造の単量体で存在し、IgAは2量体、IgMは5量体で存在しますこれらの抗体は、生物学的な機能はもちろん、物理学的な性質にも違いがあり、精製手法が異なってきます。
IgG
最初に発見された抗体で、動物体内に最も多量に存在し、感染防御の中心的役割を担っています。ヒトには細かな構造の違いによる4つのサブクラス(IgG1, IgG2, IgG3, IgG4)があり、それぞれS-S結合の位置や数が異なります。他の動物種のIgGにも複数のサブクラスがあり、構造や性質が異なります。同じ動物種でもサブクラスによってProtein AやProtein Gに対する親和性が異なるので、モノクローナル抗体の精製では、サブクラスの種類を精製の前に調べる必要があります。 |
|
IgM
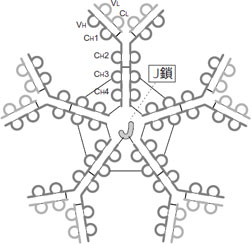
Y字型の基本構造分子がS-S結合で放射状に連結された、非常に巨大な5量体(分子量900 kDa)として存在します。分子量が大きいため、ゲルろ過クロマトグラフィーである程度分離することができます。J(joining)鎖を中心に持っており、Fc領域は中央に位置するためProtein AやProtein Gは結合できず、Fab領域と弱く結合します。 免疫の初期応答ではたらき、B細胞表面に細胞膜結合型のIgMとして発現してB細胞の抗体産生に関与しています。免疫応答の段階が進むと、B細胞から分泌型IgMとして血中に分泌され、主に細菌などの粒子状抗原に対して働きます。 |
|
IgA
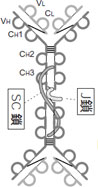
体表面の粘膜や、消化器・呼吸器など局所的な免疫機構を担っている抗体です。血清型と分泌型の2種類があり、血清型の90 %は単量体で存在します。一方、初乳や唾液などに含まれる分泌型はJ(joining)鎖(約16 kDa)とSC(secretary component)と呼ばれるペプチドで重合した2量体IgAとして存在します。初乳や唾液中の濃度は血中のIgGよりもはるかに高い濃度で存在します。 |
|
IgD
ヒト血清中には0.02~0.04 mg/mlと非常に低濃度でしか存在せず、熱に不安定でプロテアーゼなどでも分解されやすい抗体です。B細胞の表面に発現していることから、抗体の産生に関与していると考えられていますが、機能についてはまだよく知られていません。 |
|
IgE
単量体の中では分子量が最も大きく、アレルギー応答反応に関係する抗体です。血中濃度は非常に低く、半減期も短いため精製が困難な抗体の1つです。マスト細胞の表面に発現し、アレルゲンを結合するとヒスタミンをはじめとするメディエーターを放出させアレルギー応答を引き起こします。 |
|
Yolk sac IgY
IgY (Immunoglobulin Yolk)と呼ばれ、ニワトリの卵黄中に高濃度で存在する抗体です。卵黄中の濃度は約10 mg/ml、分子量は約180 kDaでIgGよりも大きく、Protein A やProtein Gとは結合しません(Kronvall, 1974)。 |
|
ポリクローナル抗体とモノクローナル抗体
図3 ポリクローナル抗体とモノクローナル抗体
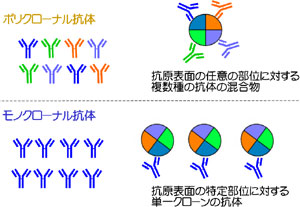
つづいて、ポリクローナル抗体とモノクローナル抗体の違いについて説明します。
すべての抗体分子は1種類のエピトープ(抗体が認識する抗原の領域)を認識しますが、一般に、ウサギやヒツジを抗原で免疫して得られ、様々なエピトープを認識する抗体が混合している状態のものをポリクローナル抗体と呼び、ハイブリドーマ細胞が産生するエピトープが均一な抗体をモノクローナル抗体(MAb)と呼びます(図3)。モノクローナル抗体は抗原特異性が高いため特定のタンパク質をターゲットにする実験や定量的な実験に使用され、ポリクローナル抗体は定性的な実験に多用されます。
モノクローナル抗体とポリクローナル抗体は作製方法が異なるため、精製方法が異なってきます。
たとえばポリクローナル抗体の場合は血液から抗体を作製するため、アルブミンなどの血中のタンパク質を除去する前処理が必要です。また、血中に内在していたさまざまな抗体が混ざっているため、Protein A / Gによるアフィニティー精製で回収を行ったのち、抗原をリガンドとして結合したアフィニティーカラムで再度精製を行い、目的の抗体以外を排除するステップを設けるのが一般的です。(図4-1)。
対して、モノクローナル抗体の場合は、ハイブリドーマによって産生・スクリーニングされた抗体をマウスの腹水から回収し、Protein A/Gのアフィニティークロマトグラフィーを行います(図4-2)。
図4-1 ポリクローナル抗体の作製手順
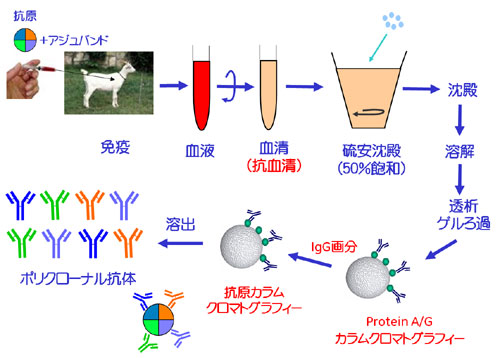
|
図4-2 モノクローナル抗体の作製手順
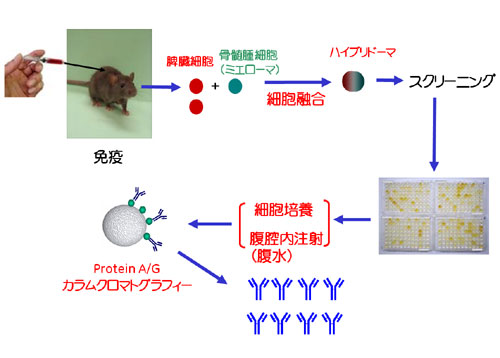 |
抗体には、一次構造を認識するものと立体構造(コンフォーメーション)を認識するものがありますが、立体構造を認識するモノクローナル抗体の場合、変性剤(尿素や塩酸グアニジンなど)や還元剤(DTTや2-MEなど)の存在下で抗原のコンフォーメーションが変化すると、抗原を認識できなくなることがあります。他方でポリクローナル抗体は多種類の抗体の集合なので、コンフォーメーションを失った抗原に対しても抗原抗体反応を起こすことがあります。
抗体の物理化学的性質・生物学的性質
抗体にはさまざまな構造や性質のクラスが存在し、各クラスには固有の物理化学的性質があります(図5)。とはいえ、分子量が巨大なIgMのような例外を除けば、精製の初めの段階から分子量や等電点の情報だけに依拠して精製を行うことは困難であり、得策ではありません。抗体の精製においては、ほとんどの場合で簡便かつ特異性の高いアフィニティークロマトグラフィーを利用できるので、ゲルろ過やイオン交換を用いる以前に、短時間、高純度な精製が可能なアフィニティークロマトグラフィーをまず行います。その後、求める純度など、必要に応じてイオン交換やゲルろ過を行います。
サブクラスごとの等電点や分子量は、その際の大まかな目安になります。
以上の理由から、クラスごとの性質の違いでは、抗体サブクラスごとのProtein A/Gとの結合性の違いが最初の目安になります(図6)。動物種・抗体のサブクラスごとにProtein A/Gとの結合性が異なるので、それぞれに最適なリガンドを選択します。
図5 代表的な抗体クラスの物理化学的性質
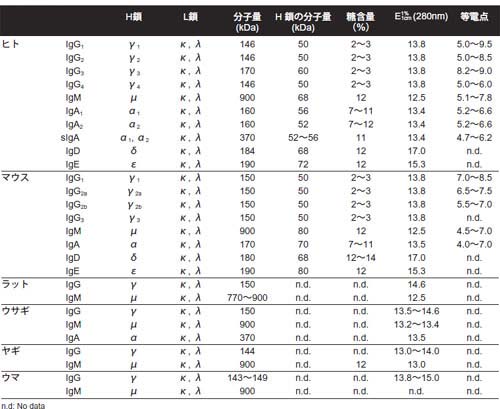
※モノクローナル抗体の場合はこれらの数値から外れる場合があります。
図6 代表的な抗体クラスの生物学的性質
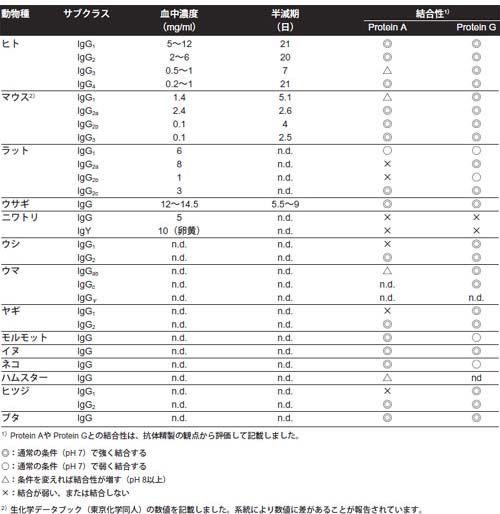
以上、第1回では抗体の成り立ちについて基本的な知識をご紹介しました。
抗体の精製方法は、抗体のクラスや作製方法によって変化しますが、その理由と意味を理解するためには、抗体の基本構造、クラスごとの構造や性質の違い、モノクローナル抗体とポリクローナル抗体の作製方法の違いを踏まえておくことが欠かせません。
次回は、抗体精製の基本スキームと、抗体を精製して使用するさまざまな実験技法についてご紹介します。
Technical Tips一覧へ戻る




 抗体はライフサイエンス研究全般において必須の道具の一つで、免疫学的測定・解析をはじめとして、細胞やタンパク質の機能解析、遺伝子の発現スクリーニングなどの基礎研究においても利用されています。1975年にKöhlerとMilsteinによってモノクローナル抗体を産生するハイブリドーマ細胞株の樹立方法が確立されて以来、生命現象を個々のタンパク質レベルで研究するための最も重要なツールのひとつとして活用されてきていることは言うに及びません。さらには、昨今では近未来の医療を担う抗体医療の直接的な手段として、世界各国の製薬企業が抗体医薬品の研究開発に大きな力を注いでいます。
抗体はライフサイエンス研究全般において必須の道具の一つで、免疫学的測定・解析をはじめとして、細胞やタンパク質の機能解析、遺伝子の発現スクリーニングなどの基礎研究においても利用されています。1975年にKöhlerとMilsteinによってモノクローナル抗体を産生するハイブリドーマ細胞株の樹立方法が確立されて以来、生命現象を個々のタンパク質レベルで研究するための最も重要なツールのひとつとして活用されてきていることは言うに及びません。さらには、昨今では近未来の医療を担う抗体医療の直接的な手段として、世界各国の製薬企業が抗体医薬品の研究開発に大きな力を注いでいます。