抗体精製をマスターしよう (2)
抗体精製の基本スキーム
 第1回では抗体の精製に深く関わってくる構造や種類の違いについて、基本的な知識をご紹介しました。
第1回では抗体の精製に深く関わってくる構造や種類の違いについて、基本的な知識をご紹介しました。
第2回は、この連載シリーズで詳細な精製方法をご紹介してゆくにあたり、抗体精製の基本的な流れと抗体の精製が必要となる実験技法について概要をご紹介します。
すべてのタンパク質は分子量、等電点(電荷)、疎水性、生物学的親和性の点で互いに異なる生化学的性質を持ち、この多様性のために、タンパク質の精製はルーチン化が難しいと思われがちです。 しかし、構造的・物理化学的な共通点がある抗体精製においては、アフィニティークロマトグラフィーを起点に、抗体の種別ごとに基本となる精製スキームが確立されています。
抗体精製の基本スキーム
タンパク質の精製方法は目的とするタンパク質の生化学的性質に大きく依存します。そのため、あらかじめ目的タンパク質の分子量・等電点、疎水性度などがわかっていると精製ストラテジーを立てやすくなります。抗体の場合は、種類ごとに一定の基本構造があるためアフィニティークロマトグラフィーを活用できることに加え、分子量やおよその等電点がわかっており、精製プロトコールも確立されているので、他のタンパク質よりもむしろ精製は容易です。
抗体精製の流れは、一般的なタンパク質と同様、清澄化・回収・中間精製・最終精製という4つのステップに分けて考えることができます(図1)。抗体の種類ごとに各ステップで異なるクロマトグラフィー手法を用いますが(表1)、段階的に純度を高め、目的の抗体の選択性を高めていく点ではいずれも共通しています。
図1 抗体精製の基本スキーム
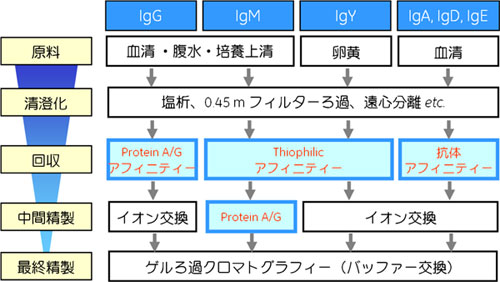
最初のステップは清澄化(Clarification)です。この操作は、クロマトグラフィーを行う前に、出発材料から抗体以外のタンパク質や固形物をできるだけ除去することが目的です。抗体の種類ごとに血清や腹水、ハイブリドーマ細胞培養液など出発材料が異なり、含有物も異なるため、原料の調整方法も異なってきます。塩析やフィルターによるろ過、遠心分離などを用いて清澄化を行います。(この操作の詳細は第4回でご紹介します。)
次の回収(Capture)ステップでは処理スピードと処理容量が重要なファクターで、目的タンパク質を細胞抽出液などのクルードな状態から速やかに分離・濃縮することを目的とします。これにより、サンプル溶液中での目的タンパク質の安定性が向上し、以降の精製操作が容易になります。
すでに述べた通り、抗体精製ではこの最初の回収のステップでアフィニティークロマトグラフィーを用いるのが一般的です。IgGの場合にはProtein A やProtein G をリガンドとした非常に特異性の高いアフィニティークロマトグラフィーにより、ワンステップで純度90%以上の精製が可能です。他方で、IgG以外の、Protein A/Gとの親和性が低い抗体では、別のアフィニティーを利用します。たとえば、IgMやIgYではThiophilic interactionを利用したアフィニティー精製が適しており、近年開発されたIgM・IgYの親和性が高いリガンドである2-メルカプトピリジンを結合したアフィニティーカラムを使うのが一般的です。他の抗体(IgA, IgD, IgE)の場合は、血中濃度が低いことや、親和性の高いアフィニティーリガンドがないことから、その抗体を認識する二次抗体を固定したアフィニティーカラムによる回収が一番確実な方法です。
つづく中間精製(Intermediate purification)ステップでは、回収ステップで目的の抗体といっしょに回収されてしまった様々な夾雑物を除去します。 このステップでは、まだサンプル量が多いので、処理量が大きいイオン交換クロマトグラフィーが一般的に用いられます。等電点の情報がない場合は、あらかじめ電気泳動で等電点を調べておきます。抗体のタイプや出発材料によっては再度アフィニティーを使うこともあります。たとえば、血清からIgMを精製する場合、第一段階のThiophilicアフィニティーでIgGが一緒に回収されてしまいます。そのため、中間精製のステップではこのIgGをProtein A / Gのカラムでトラップし、IgM分画をフロースルーで落としてきます。
なお、サンプル量が少ない場合は、回収と中間精製をワンステップで行うこともあります。
最後の最終精製(Polishing)ステップは、わずかに残存する夾雑物を高性能カラムを用いて分離し、最終的な精製タンパク質とするためのステップです。抗体精製では、高分離能なカラムによるゲルろ過クロマトグラフィーを最後に行うのが一般的です。ゲルろ過を用いることで、構造解析を阻害するレベルの低分子物質の除去とあわせて、バッファーの交換も行うことができます。
表1 抗体精製で用いられる主なクロマトグラフィー手法
このように、抗体の精製ではまずはじめにアフィニティークロマトグラフィーで大まかな回収を行い、つづいて純度を高めるため、抗体と不純物の等電点・分子量の違いを利用してイオン交換クロマトグラフィーとゲルろ過クロマトグラフィーによる精製を行うのが基本です。
ただし、抗体の性質によってはこのスキームが適用できないケースもあります。たとえば 酸性の溶出条件(pH2~3)で失活する恐れのある不安定な抗体は、アフィニティークロマトグラフィーは使わずに温和な条件で精製できるゲルろ過やイオン交換・疎水性相互作用クロマトグラフィーなどを用いて精製します。
本連載では、上にご紹介した基本スキームが適用できる精製方法から、特殊な対応が必要な精製方法まで、順を追って詳細にご紹介して参ります。抗体のタイプごとの精製ストラテジーは次回にご紹介します。
抗体を用いる実験技法
以上、抗体の精製の基本的な流れをご紹介しましたが、さらに理解を深めるために、そもそもの抗体精製を行う目的、精製を行ったあとの用途に目を向けて、 抗体を用いる一般的な実験手法と、求められる抗体の純度について見てみましょう。
生化学や医療の分野では様々な実験で抗体が使用されており、ELISAのような高感度な定量性を要求される実験から免疫沈降のような定性的な性質を利用した実験まで、使用される抗体の純度や必要量は様々です。基本的に、精製純度を高めるほど、回収できる抗体の量は減少するので、抗体の精製を行う前に、どういう目的で抗体を精製するのか、精製した後どのように使用するのかを確認した上で、最適な精製手法を選択することが大切です。
免疫沈降法
クルードなサンプル中に存在する抗原を、抗体を用いて釣り上げる分析手法です。抗原に結合した抗体は、Protein AやProtein Gをカップリングしたゲル担体(Protein A/G Sepharose™ など)に結合するため、遠心操作で簡単に夾雑タンパク質を分離することができます。このあとSDS-PAGEやLC/MS解析など用いて、抗体に結合したタンパク質を確認します。抗原以外のタンパク質も混入することがあるため定量性は低く、定性的な分析に向いています。クルードな原料で抗原抗体反応を行うことが多いため、抗体の特異性、力価が高くなければ目的タンパク質を特定することは困難となります。抗原を特定するためには、抗体の精製純度は高いもの(純度95 %以上)が要求されます。ウェスタンブロッティングと組み合わせることにより、サンプル中の目的抗原の検出も可能になります。
ウェスタンブロッティング
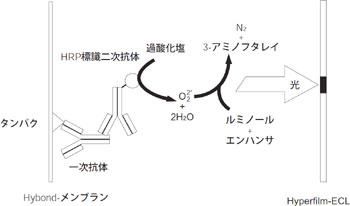 図2 ECL™の検出原理
図2 ECL™の検出原理
電気泳動したタンパク質をメンブランに転写し、メンブラン上で抗原タンパク質を検出する方法です。抗原タンパク質の分子量や抗体との反応性を視覚的に確認できます。発色法から弊社
ECL™ Plusのような化学発光法などの新しい検出方法が次々に開発されています。化学発光検出法の1つ
ECL™(Enhanced Chemi Luminescence)は、CBB染色の10,000倍の感度に相当します。 ECL™の検出原理を
図2に示します。転写されたメンブランは、抗体が非特異に吸着しないようにブロッキング剤(BSAやスキムミルクなどが使用されます)で処理します。メンブランに固定された抗原タンパク質は、まず、その抗原に対する特異抗体(一次抗体)で認識され、続いて標識二次抗体(一次抗体を認識する抗体)を反応させて検出します。二次抗体には一次抗体を作製した動物種の抗体に特異的な抗体を使用します。 電気泳動の分離能自体が高いため、高い抗体価の抗血清であれば、未精製のままでも利用することができます。しかし、抗体価が低い場合には非特異タンパク質の検出が多くなるので、Protein AやProtein Gカラムによる精製が必要です。
セルソーティング
細胞表面抗原に対するモノクローナル抗体を用いた細胞のタイピングや、セルソーターによる細胞分離に使用されます。例えば白血球の表面抗原にあるCD(Cluster of Differentiation)抗原は、疾患の診断などでも活用されます。 抗体を色素で直接標識して使用する場合には、95 % 以上の高純度な抗体が必要です。血清入りハイブリドーマ細胞培養液や腹水から精製した抗体の場合,ホスト由来のIgGが混入している場合があるので、これらを徹底して除く必要があります。標識二次抗体を使用する場合にはホスト由来IgGの混入は無視できるので、高純度に精製する必要はありません。特異性の高い無血清培地で発現したモノクローナル抗体であれば、未精製でも使用可能な場合があります。
抗原精製
定量的な目的で抗原を精製する場合の技法です。生体中での発現量が微量なタンパク質の精製は極めて困難で、様々なクロマトグラフィーを組み合わせて目的タンパク質を精製していきます。精製ステップが増えるごとに回収率が下がるため多くの原料を必要とし、タンパク質の変性や失活といった問題も生じてきます。目的タンパク質に対する抗体が入手可能な場合は、抗体カラムを作製して簡便に高純度な抗原を精製することができます。抗体は精製純度の高いもの(95 %以上)を使用します。
免疫電気泳動
サンプルを電気泳動後、ゲルに抗体を挿入し、その抗体やサンプル中の抗原を拡散させます。拡散により抗原と抗体が接触した場合、白い沈降線が生じます。サンプルは、この白い沈降線の状態により分析します。電気泳動とゲル拡散沈降法を組み合わせた実験法では、サンプル中の抗原の特徴を視覚的に観察することができます。不純物の影響を受けにくいので硫安沈殿など簡単な方法で精製した純度60 % 程度の抗体でも使用できます。
免疫組織染色
動植物の組織切片を使用して目的タンパク質の局在を調べる方法で、特異性の高い抗体が必要です。ポリクローナル抗体の場合には、抗原カラム、モノクローナル抗体の場合はProtein AやProtein Gカラムを用いて95 %以上の純度で精製することが必要です。
ELISA(Enzyme Linked Immunosorbent Assay)
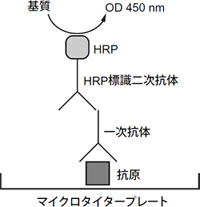 図3 ELISAの測定原理
図3 ELISAの測定原理
血清などのサンプル溶液中の抗原の定量に使用されます。抗原を抗体でトラップし、ペルオキシダーゼなどで標識した抗体を使用して、基質の発色から抗原量を定量します。抗体中のわずかな不純物も誤差の原因になるため、高純度な抗体(純度95 %以上)を使用しなければなりません。実験結果の精度を上げるために、二種類の抗体 で抗原を挟み込む方法(Sandwitch ELISA)も使用されています。
以上、第2回では抗体精製の基本的な流れと、抗体の用途について概要をご紹介しました。
抗体は種類も性質も多用で、その精製は一見複雑ですが、基本的な性質の違い・場合ごとの対応方法を理解すれば、ルーチンの精製スキームに落とし込んで精製することが可能です。
第3回では、今回ご紹介した抗体精製の基本スキームをさらに掘り下げ、それぞれの抗体の種類・性質に応じた精製ストラテジーをご紹介します。
Technical Tips一覧へ戻る





