
|
|||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
|||||||||||||||||||||||||||||||||||
|
Location:Home > テクニカル情報配信サービス > バイオダイレクトメール > バイオ実験の原理と方法 |
|||||||||||||||||||||||||||||||||||
抗体精製をマスターしよう (3)抗体精製のストラテジー
ポリクローナルIgGの精製ストラテジーこのストラテジーを使う精製プロセス→ ポリクローナルIgGの回収
表1 動物種・サブクラスによるProteinA/Gとの結合性の違い
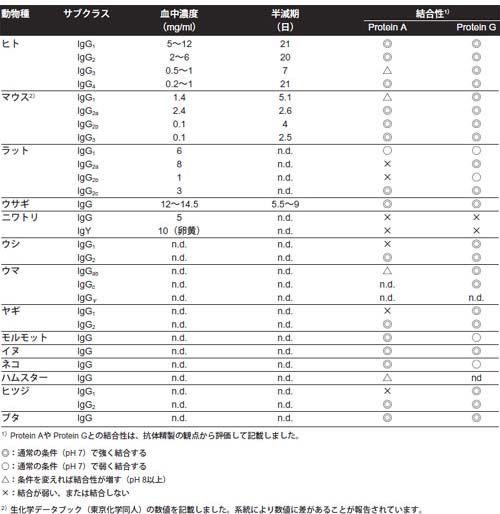 ヒトヒトIgGには4種類のサブクラスがあり、Protein AにはIgG3を除く3種類のIgGが、Protein Gには全4種類のIgGが強く結合します。ただ、Protein Aの場合でも、結合のステップで溶液のpH を8以上にすればIgG3を結合・回収できます。 Protein Aを使用する場合、IgMもFab領域で弱いながら結合するので、IgMが分画に混入しないよう溶出に注意が必要です。すべてのIgGサブクラス はpH 3.9でほとんど溶出し、その後、より酸性側のバッファー(pH 4 ~2.5)を流すとIgMとIgAが溶出します。ですので、Protein Aを使う場合にはpH 3.9で溶出するとIgMの混入を最小限に抑えることができます。 ヒトIgGサブクラスとProtein Aカラムからの溶出pH
ウサギウサギのIgGにはサブクラスはなく、Protein AとProtein Gの両方に強く結合し、ほとんどの抗体はpH 3で溶出されます。また、ウサギIgMはProtein Aには結合しないと報告されてるので、Protein Aを用いることで、簡単に高い純度のIgGを回収できます。 マウスマウスでは、すべてのIgGがProtein Gに結合します。そのため、ポリクローナル抗体の精製にはProtein Gが便利ですが、Protein Aカラムでも工夫すれば対応可能です。 Protein Aを使う場合は、IgG1は親和性が弱いため、標準的な結合バッファー(20 mM リン酸ナトリウム、pH 7.0)ではカラムを素通りしてしまいます。ただし、マウスの場合は血清サンプルのNaCl濃度を高くするとすべてのIgGをProtein Aカラムに結合させることができます。また、pH グラジエントで溶出を行うとサブクラスの分画が可能です。 IgMの混入については、マウスIgM はヒトIgMと比べるとProtein AやProtein Gへの結合は弱いため、IgG画分へのIgMの混入は少なくなります。 マウスIgGサブクラス とProtein Aカラムからの溶出pH
ラットラットでは、Protein Gが4種類すべてのサブクラス(IgG1, IgG2a, IgG2b, IgG2c)と標準の結合バッファー(20 mM リン酸ナトリウム, pH 7.0)で結合します。他方で、Protein AはIgG2c しか結合しないため、ポリクローナル抗体の精製には適していません。 ヤギIgG1とIgG2の2つのサブクラスがあり、Protein Gはいずれのサブクラスにも結合します。Protein AにはIgG1は結合せず、IgG2はpH 5.8で溶出します。 ヒツジIgG1とIgG2の2つのサブクラスがあり、Protein Gはいずれのサブクラスにも結合します。IgG1はProtein Aに結合しません。 IgG以外のポリクロナール抗体の精製ストラテジーこのストラテジーを使う精製プロセス→ ポリクローナルIgM / IgYの回収
ポリクローナルIgMかつては、IgMは、分子量が900 kDaの大きなタンパク質であるという特長を利用し、硫安沈殿したサンプルをゲルろ過クロマトグラフィーにかけることで粗精製していましたが、近年では、IgMと2-mercaptopyridineがThiophilic interactionで結合する性質を利用したアフィニティー精製を用いるのが一般的です。(HiTrap™ IgM Purification カラムなど)ほかに、二次抗体をリガンドとした精製法もありますが、二次抗体が高価であるため大量精製には向きません。 注意点としては、2-mercaptopyridineには血清中の多種類のタンパク質も結合するので、血清サンプルからスタートするポリクローナルなIgMの場合は、ゲルろ過クロマトグラフィーなどを組み合わせて夾雑タンパク質とIgMを分離する必要がある点があげられます。IgMのゲルろ過クロマトグラフィーにはSuperdex™ 200担体あるいはSephacryl™ S-200 HR担体が適しています。 Yolk sac IgYIgY(Immunoglobulin Yolk)は鶏卵の卵黄中に存在するポリクローナル抗体の一種で、IgGと類似した構造をしています。卵黄には唯一の抗体成分としてIgYが存在するほか、大量のリポタンパク質(LDL、HDL)が含まれています。IgYとIgGは分子量や等電点などの物理化学的な性質が異なるほか、Protein AやProtein Gとは結合しないなど生化学的な性質も異なります。2-mercaptopyridineにThiophilic Interactionで結合する性質を使用したHiTrap™R IgY Purificationカラムによって、短時間の精製が可能となっています。 IgA, IgD, IgEProtein AやProtein Gはこれらの抗体に対する親和性が弱いため、精製に使用するのは実用的ではありません。これらの抗体は、二次抗体を利用した免疫特異的な方法で精製されます。詳しくは、免疫特異的な精製ストラテジーの項で解説させていただきます。 モノクローナル抗体の精製ストラテジーこのストラテジーを使う精製プロセス→ モノクローナルIgG / IgM の回収
モノクローナルIgGマウスIgGの精製には4種類すべてのIgGが結合するProtein Gが適しています。 Protein Aの場合には、IgG1の結合は他のサブクラスIgGに比べて非常に弱く、pH 7 ~ 6で溶出してしまいます。そのため、サンプルと結合バッファーのpHおよび塩濃度を至適化する必要があります。マウスのIgGでは各サブクラスに適したpHで溶出を行い、必要以上に過酷な条件にさらさないように注意します。 モノクローナルIgM上述のポリクローナルIgMと同様、Thiophilicアフィニティー精製を用いるのが一般的です。(HiTrap™ IgM Purificationカラムなど) ただし、Thiophilicアフィニティーのリガンドに用いる2-mercaptopyridineは血清中のいろいろなタンパク質と結合する性質を持っているため、血清添加した培地を使う場合は、溶出画分にIgMのほか血清由来のタンパク質が混入します。この場合は、溶出画分をさらにSuperdex™ 200担体あるいはSephacryl™ S-200 HR担体を利用したゲルろ過クロマトグラフィーで精製する必要があります。ハイブリドーマ細胞培養液のようにサンプル量が多い場合は、処理スピードの速いイオン交換クロマトグラフィーを用いると処理時間を短縮できます。 無血清培地の場合はワンステップ精製が可能です。 不安定な抗体の精製ストラテジーこのストラテジーを使う精製プロセス→ 酸性での溶出で失活するモノクローナル抗体の精製
イオン交換クロマトグラフィー血清添加ハイブリドーマ培養細胞液の中に含まれる主要な不純物はalbuminやtransferrinで、それらの等電点は4.7 ~ 5.0です。ヒトおよびマウスの大部分のIgGの等電点はそれよりも塩基性側(pI 5 ~ 9.5)にあるため(表1 参照)、陽イオン交換でそれらの不純物を素通りさせて除去します。不純物がカラムを素通りするためにイオン交換体の大部分の吸着容量を抗体に使うことが可能で、培養上清のように希薄な抗体溶液のサンプルで良好な濃縮効果も期待できます。抗体を含む吸着成分は塩濃度グラジエント溶出で高純度に精製されます。 陰イオン交換体は腹水や硫安沈殿したサンプルから抗体を精製することに使用されてきたほか、パイロジェンや核酸、プロテアーゼの除去としても有効です。しかし、IgGより等電点の低い不純物を強く結合し、ほぼ同じ等電点をもつtransferrinの分離が難しいため、さらにゲルろ過クロマトグラフィーなどの精製が必要となります。 疎水性相互作用クロマトグラフィーサンプルを硫安沈殿で清澄化した場合には、バッファー交換することなく続けて疎水性相互作用クロマトグラフィーで精製することができます。この手法ではリガンドと目的抗体の吸着の程度を予想することが困難です。したがってリガンドをもつカラムの中から最適なリガンドを持った担体を選択するスカウティング実験が重要になります。弊社ではスカウティング用カラムとして、7種類のリガンドをセットにしたHiTrap™ HIC Selection Kit and HiTrap™ HIC Columnsを用意しています。 IgGの純度を重視した精製ストラテジーこのストラテジーを使う精製プロセス→ ポリクローナルIgG / モノクローナルIgG の中間精製・最終精製
ホスト由来のIgG の除去分子量も電荷もよく似た添加血清やホスト由来のIgG は、Protein AやProtein Gカラムから溶出する際にpHグラジエントをかけると分離できる場合があります。また、2つのIgGの疎水性度の違いを利用して、疎水性相互作用クロマトグラフィーで分離した例もあります。 Transferrin とalbumin の除去少量のサンプルからtransferrin(76 kDa)やalbumin(67 kDa)を除去するには、分子量の違いを利用したゲルろ過クロマトグラフィーがもっとも簡単な方法です。サンプルが大量にある場合は、処理容量の大きいイオン交換クロマトグラフィーで等電点の違い(ヒトとマウスの場合: pI が4.7 ~ 5.0)を利用して分離します。陽イオン交換体と陰イオン交換体のどちらが適当かは、目的IgGの等電点に依存するので予備実験が必要です。 脱離したリガンドの除去アフィニティーカラムからのリガンド漏出は極微量のため通常の実験では問題になりません。しかし、ELISAなどの高感度実験では測定値の誤差の原因となる場合もあります。また、医薬品などの製造ではリガンドの除去は必須事項です。 除去方法としては、ゲルろ過クロマトグラフィーがもっとも簡単で、温和な条件で行えます。イオン交換クロマトグラフィーで除去する場合は、目的の抗体の等電点によって陽イオン交換体と陰イオン交換体を使い分けます。
表2 精製IgG に含まれる漏出したProtein Aリガンド
アフィニティークロマトグラフィーで目的物質を精製する場合、溶出条件下でリガンドもわずかに漏出します。表2に示すように精製IgGの中に微量ではありますが、リガンドの混入が見られます。Protein A Sepharose™Rはタンパク質のアミノ基を利用してCNBr-activated Sepharose™担体に多点結合しています。rProtein A Sepharose™はカルボキシ末端に導入したシステイン残基のSH基を利用してEpoxy-活性化Sepharose™ 4 FFゲルに1箇所で結合(1点結合)しています。末端1箇所で結合してリガンドの方向性をそろえることによりIgGの結合容量は増しましたが、多点結合したProtein A Sepharose™と比べると脱離しやすくなります。 弊社製品はISO 9001の承認を得た工場において厳密な製造管理基準の下に生産されており、欧米の当該機関から求められる品質保証や技術サポートおよび各種規則に合致するように生産されています。 抗原カラム、抗体カラムを利用した免疫特異的な精製ストラテジーこのストラテジーを使う精製プロセス→ ポリクローナル抗体 / IgA・IgD・IgEの回収
抗原特異的な特異抗体Protein AやProtein Gカラムで精製した総IgG画分の中から、抗原に特異的な抗体(特異抗体)だけを精製します。特異抗体にすることで非特異的反応が減少し、ELISAでは定量濃度範囲が広がります。 特定のサブクラスの抗体Protein AやProtein Gカラムでは特定のサブクラスの抗体だけを選別して精製することは困難です。目的のサブクラス抗体だけを認識する抗体があれば、その抗体をカップリングしたカラムによって特定のサブクラスIgGだけを精製することができます。 Protein A やProtein G で精製できないIgA、IgD、IgEIgA、IgD、IgEは血中濃度が低い上に、Protein AやProtein Gに対する親和性がIgGよりも弱いため精製が困難です。目的の抗体に対する二次抗体を固定したカップリングゲルを用いて、目的の抗体を精製することができます。これらのカラムに結合した抗体は、一般には溶出バッファーのpHを酸性(pH2 ~ 3)にして溶出します。(詳細は弊社発行のアフィニティークロマトグラフィーハンドブックをご参照ください) カップリングゲルとしてはリガンドのアミノ基(-NH2)を利用するNHS-activated Sepharose™4FFやCNBr-activated Sepharose™ 4FF/4B担体が使用できます。最近開発されたNHS-activated Sepharose™ 4FFは、短時間で安定したカップリングが終了可能(室温で15 分間)で、少量のゲル(1 ml または5 ml)が充填された使いやすいプレパックカラムHiTrap™ NHS-activated も販売しています。 以上、第3回では、抗体精製の考え方をより掘り下げるため、精製のポイントになる詳細なストラテジーをご紹介しました。 お問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
|||||||||||||||||||||||||||||||||||
© 2026 Cytiva
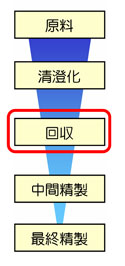 研究にもっともよく使用されるポリクローナルIgGの精製においては、回収のステップで行われるアフィニティークロマトグラフィーでの、Protein A/Gとの結合性が一番のポイントです。動物種やIgGのサブクラスによってProteinA/Gとの親和性が異なるため
研究にもっともよく使用されるポリクローナルIgGの精製においては、回収のステップで行われるアフィニティークロマトグラフィーでの、Protein A/Gとの結合性が一番のポイントです。動物種やIgGのサブクラスによってProteinA/Gとの親和性が異なるため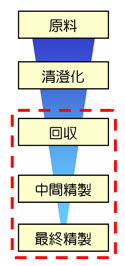 抗体精製の基本はProtein AやProtein Gを使ったアフィニティークロマトグラフィーですが、この手法は溶出時にpH 3付近の酸性バッファーを使用するため、中には失活してしまうモノクローナル抗体があります。(ポリクローナル抗体の場合は複数のクローンが混在しているため、全体としては失活しません) ヒトやマウスIgGのようにサブクラスごとのおおよその溶出pHがわかっている場合には、そのpH条件で溶出することにより抗体の失活を未然に防ぐことができますが、そうしたデータが無い不安定な抗体の精製では、アフィニティークロマトグラフィーの代わりに、イオン交換や疎水性相互作用クロマトグラフィーなどの温和な方法で精製します。
抗体精製の基本はProtein AやProtein Gを使ったアフィニティークロマトグラフィーですが、この手法は溶出時にpH 3付近の酸性バッファーを使用するため、中には失活してしまうモノクローナル抗体があります。(ポリクローナル抗体の場合は複数のクローンが混在しているため、全体としては失活しません) ヒトやマウスIgGのようにサブクラスごとのおおよその溶出pHがわかっている場合には、そのpH条件で溶出することにより抗体の失活を未然に防ぐことができますが、そうしたデータが無い不安定な抗体の精製では、アフィニティークロマトグラフィーの代わりに、イオン交換や疎水性相互作用クロマトグラフィーなどの温和な方法で精製します。 抗体精製は、実験環境や求められる純度によっては簡単な回収で済ませるケースもあり、たとえばProtein AやProtein Gを使ったアフィニティークロマトグラフィーは非常に特異性の高い精製法で、90 %近い純度のIgGを精製することができます。 しかし、実験によっては混入したタンパク質がたとえ微量であっても結果に大きく影響することがあるため、基本的に「清澄化→回収→中間精製→最終精製」という流れで進めるのが理想的です。不純物がバックグラウンドを高めたり、予期せぬ影響を与えたりすることを防ぐためには、完全な除去が必要です。 たとえば、ハイブリドーマ細胞培養液から精製した抗体には、培地に添加したウシ血清由来のIgGやalbumin、transferrinなどが微量に混入することがあります。腹水から精製した抗体にも、採取時に混じった血液由来のIgG が混入することがあります。また、アフィニティーゲル担体からリガンドのProtein AやProtein Gが脱離することもあります。これらの不純物はイオン交換クロマトグラフィーや疎水性相互作用クロマトグラフィー、ゲルろ過クロマトグラフィーなどの手法で除去できます。
抗体精製は、実験環境や求められる純度によっては簡単な回収で済ませるケースもあり、たとえばProtein AやProtein Gを使ったアフィニティークロマトグラフィーは非常に特異性の高い精製法で、90 %近い純度のIgGを精製することができます。 しかし、実験によっては混入したタンパク質がたとえ微量であっても結果に大きく影響することがあるため、基本的に「清澄化→回収→中間精製→最終精製」という流れで進めるのが理想的です。不純物がバックグラウンドを高めたり、予期せぬ影響を与えたりすることを防ぐためには、完全な除去が必要です。 たとえば、ハイブリドーマ細胞培養液から精製した抗体には、培地に添加したウシ血清由来のIgGやalbumin、transferrinなどが微量に混入することがあります。腹水から精製した抗体にも、採取時に混じった血液由来のIgG が混入することがあります。また、アフィニティーゲル担体からリガンドのProtein AやProtein Gが脱離することもあります。これらの不純物はイオン交換クロマトグラフィーや疎水性相互作用クロマトグラフィー、ゲルろ過クロマトグラフィーなどの手法で除去できます。 ポリクローナル抗体の精製において、回収後に単一のクローンにしたり、サブクラスを絞り込んだりするケースがあります。その場合、回収のステップの後に、抗原や抗体を固定したカラムを用いてアフィニティー精製を行います。
ポリクローナル抗体の精製において、回収後に単一のクローンにしたり、サブクラスを絞り込んだりするケースがあります。その場合、回収のステップの後に、抗原や抗体を固定したカラムを用いてアフィニティー精製を行います。
