|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Location:Home > テクニカル情報配信サービス > Pharma Mail |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 マイクロキャリアとVero細胞を用いたインフルエンザワクチン製造
ワクチンの準備ワクチン接種プログラムにより年間数百万人の生命が救われていますが、ワクチン不足のため死亡する人は依然として数百万人を超えています。規制上のハードルが高く、投資対効果がさほど高くないという見解から、この市場に参入しようとする製薬会社は多くありません。実際、この数年でワクチン製造会社の数は減少しました。しかし、そうした状況は変化しつつあります。 開発途上国の状況はゲイツ財団やGAVIアライアンス、PATHなどの著明な諸団体の注意を引くところとなり、マラリア、エボラ出血熱、HIV、C型肝炎等の疾病に有効なワクチン接種プログラムが広範に進められています。先進国ではインフルエンザや鳥インフルエンザ、SARS等のパンデミックやバイオテロの脅威に備え、ワクチンを確実に供給するプログラムや早急にワクチン生産を開始できる方法の開発を政府レベルで行っています。 こうした変化を生じさせた主な原因に、インフルエンザ大流行の脅威があります。2006年の報告書でWHO1は、2009年までに全世界で20億回接種分のワクチンを、また長期的には約67億回接種分のワクチンを準備するという目標を設定しました。最近では、さらに大量のワクチンの準備が目標とされています。しかしながら、現在の最大生産量はせいぜい3億5千万回接種分です。この問題を、どう解決すればよいのでしょうか?パンデミックはどのような場所でも発生し、人々の移動を妨げる恐れがあるため、利用可能な十分量のワクチンを保有するか、または非常に早急にワクチンの生産を開始できるようにしておくことが課題となります。解決法のひとつは新たなワクチン製造工場を建設すること、もうひとつは移動可能なワクチン製造装置を開発することと考えられます。 しかし、工場を新設してもそれで十分とはいえません。実証済みの技術を利用した既存の工程は、全体を通して最適な状態とはいえず、ワクチンの安全性、忍容性、有効性、およびプロセスの効率に対する需要の高まりに即した改善が必要です。例えば、従来インフルエンザワクチンは鶏卵培養法によって製造されてきましたが、この方法には労力、工程所要時間、製品の取り扱い管理といった点で制限があります。そのためワクチンの製造会社は、生産規模の拡大が容易なほ乳類細胞を用いた培養法など、新しい技術を検討する必要があります。 がん、ヒトパピローマウイルス、髄膜炎菌などに対するワクチンのような、組換えタンパク質を用いた最先端科学技術によって生産された新たなワクチンが市場に参入し、状況に変化を起こしています。それらの中には大成功を収めそうなものもあり、新たなワクチンの参入が促進されると思われます。 ワクチンの供給は、それがパンデミックに対するものであれ季節性流行に対するものであれ、サプライチェーンの各工程と品質を厳しく管理し、需要に対し機敏に対応できるベンダーによって支えられた堅牢な製造プロセスを必要とします。 新たなワクチンの候補、工程の改良、生産量の増加により、ワクチン製造会社の体制はより一層整ってきてはいます。それでも、WHOの目標を達成するには、まだできることがあります。 インフルエンザワクチン生産のためのVero細胞を用いたマイクロキャリア大規模培養
インフルエンザは、罹患率が高くヒトでの死亡率も非常に高いウイルス性の呼吸器疾患ですが、インフルエンザワクチンが1940年代に導入されて以来、こうした問題は著しく低減しました。インフルエンザワクチンは3価のワクチンで、現在の製剤にはA型インフルエンザの亜種であるH1N1とH3N2、およびB型インフルエンザに対するワクチンが含まれています。ワクチン製造用のインフルエンザウイルスは、主に孵化鶏卵中で作られます。この従来の技術では、何百万個もの卵に個々にウイルスを接種し、それらを回収する必要があります。この工程は自動化が難しく、大きな労力と多大な時間を要し、汚染が生じる原因ともなります。 インフルエンザウイルスは多くの細胞株中で増殖させることができますが、バクスターは表1に示したサルの継代細胞株であるVero細胞に重点的に取り組むことにしました。
20年以上もの間、Vero細胞はヒト用で認可されたワクチン(ポリオや狂犬病など)の製造に使用されてきました。Vero細胞は広範囲のウイルスの感染を受けやすいのですが、この細胞でのインフルエンザウイルスの増殖は最初から成功したわけではありませんでした(1、2)。バクスターは、パンデミック間期(Interpandemic)のインフルエンザウイルスとパンデミック期(Pandemic)のインフルエンザウイルス(表2)、また他の多数のヒトウイルスと動物ウイルス(表3)を非常に高い力価で製造できる技術を開発しました。Vero細胞を用いたワクチン開発および製造の技術の原理と適応性については文献に記載があります(3、4、5)。
パンデミックに対する準備鳥インフルエンザウイルス(H5N1)の急速な蔓延とヒトへの感染は、世界中で新たなパンデミックに対する不安を創り出し、標準的なインフルエンザワクチンの製造法によって十分量の有効なワクチンを早急に供給できるのか懸念されました。そこでVero細胞内で増殖させた野生型(wild-type)ウイルスを用いる、堅牢で適応性のある戦略が開発されました。野生型株の全粒子ウイルスワクチン接種を行えば、H5N1型に特異的な細胞性免疫も含む高い免疫応答を誘導することができます(そのワクチンにはPR8にではなくH5N1に特異的な核タンパクと膜タンパク質が含まれています)。当社の大規模なデータから、短期間でパンデミックインフルエンザウイルスのワクチンを早急に高い収率で製造できることが確認されました。 マイクロキャリアを利用したVero細胞の大規模培養技術Vero細胞は大規模生産のために設計された血清あるいは無タンパク質培地で増殖するようにデザインされてきました。特定回数の継代を経たVero細胞のアンプル1本分を融解してTフラスコおよびローラーボトル中で継代培養し、細胞が十分に増殖した後にCytodex™ 3マイクロキャリアを用いたバイオリアクターに接種します。培養がコンフルエントな状態に達した後、培養細胞を約1:7の比率で希釈してその後バイオリアクターで継代培養します。最終的な細胞密度は2~3×106/mlです。パイロットプラントでの製造では、最終的なバイオリアクターのスケールは1200リットルでしたが、特別なエアレーション装置や撹拌装置等の工程設計によって、最終的には6000リットルの容積までスケールを拡大することができました。小規模な実験室用バイオリアクターから臨床・商業生産用のものまで、すべての開発スケールでVero細胞の継代数は同程度にしています(表4)。
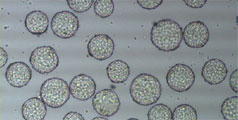
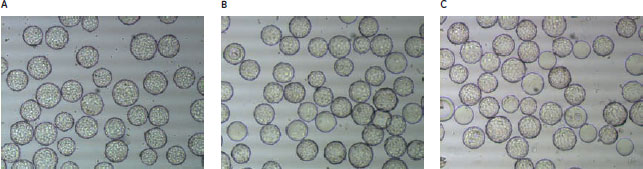
*multiple roller bottles Vero細胞を大規模に培養できる可能性接着性のVero細胞は細胞数が増加し、最大スケールの6000リットの単一のバッチで総計1.8×1013個の細胞を得ることができます。商業生産用では複数のバイオリアクターを並行して使用します。図1は、各スケールのバイオリアクター中でCytodex™ 3ビーズの表面に増殖したVero細胞の顕微鏡写真です。
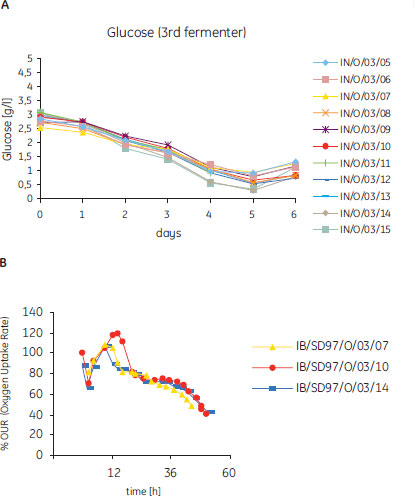
Vero細胞の培養工程では最終的な製造スケールまでバリデーションが行われ、残留グルコース濃度のプロファイルや酸素消費率といった種々の代謝パラメータが測定されています。バイオリアクターを連続運転した例を図2に示します。
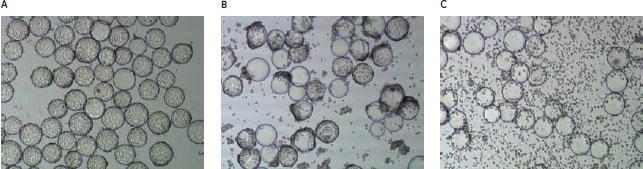
インフルエンザウイルスの大規模な製造工程ウイルス製造の際には、感染多重度(m.o.i.)が0.01 TCID50/cell(50%組織培養感染量)となるように、継代142.5回のVero細胞を各ウイルス株に感染させます。ウイルスを1時間細胞に吸着させた後、トリプシンを加えて32°C~35°Cで48~72時間さらにインキュベートします。この条件下でパンデミック間期(Interpandemic)ウイルス株とパンデミック期(Pandemic)のウイルス株の両方を増殖させることができます。ウイルス産生速度の計測と細胞変性効果の評価(図3)を行うことによって、確実で再現性のある工程を確立することができました。
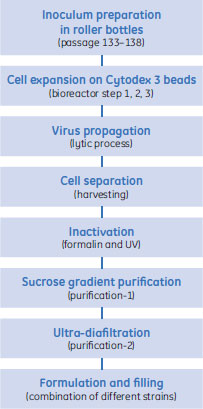
パンデミック期(Pandemic)とパンデミック間期(Interpandemic)のインフルエンザウイルスの製造工程製造用のウイルスストックの準備は重要な段階です。ウイルスの増幅は3段階で行われ、それぞれシードウイルスバンク作成、ワーキングウイルスバンク作成、製造用ウイルスバンク作成と呼ばれています。3段階で行うことで、商業生産用にウイルスを一定して長期間供給することができます。最終的に製造用ウイルスバンクを使用して6000リットルスケールの製造用バイオリアクター中の培養細胞に感染させ、その後一連の確立された製造工程へと引き継がれます(図4)。
各ウイルス株に感染してコンフルエントな状態にあるVero細胞を2~3日間培養します。細胞の回収と分離は連続遠心分離機によって行い、ウイルスを含む上清が得られます。次に活性のあるウイルスをホルマリンで処理し、さらにUV照射を行って2段階の不活性化処理を行います。不活性化されたウイルスは連続ショ糖密度勾配超遠心分離によってさらに精製され(図4、purification-1)、その結果宿主細胞の可溶性タンパク質が除去されます。この中間体は精製ウイルスと呼ばれ、ショ糖濃度はおよそ42%です。次に限外透析ろ過を行ってショ糖濃度を低下させ、精製度をさらに高めます(図4、purification-2)。この段階の最終産物は単価バルクと呼ばれます。数種の単価バルクを使用して最終的なワクチンを調合します。図5では6000リットルスケールの工業的培養、超遠心分離、限外-透析ろ過を行う製造エリアを示しています。
Vero細胞から製造したパンデミック(Pandemic)ウイルスおよびパンデミック間期(Interpandemic)ウイルスワクチンの臨床経験Vero細胞から製造した野生型インフルエンザウイルスのパンデミック間期(Interpandemic)のスプリットウイルスワクチンとパンデミック期(Pandemic)の全粒子ウイルスワクチンを用いて臨床試験が実施されており、よい評価が得られています。スプリットウイルスワクチンは季節性インフルエンザワクチンに最も多用されます。バクスターのパンデミック期H5N1型ワクチンを用いて現在ヨーロッパで第III相臨床試験が実施されていますが、これは全粒子ウイルスワクチンとして開発されたものです。Vero細胞から製造したH5N1型全粒子ウイルスワクチンは、550名の被験者に対して実施された第I/II相試験で安全性と優れた忍容性プロファイルが示されました。3.75 μgまたは7.5 µgといった低いワクチン用量でも高い免疫原性を持ち、また、クレード3の株(Hong Kong/156/1997)と近年のクレード2の株(Indonesia/05/2005)に対して交差中和活性を示しました。 ヨーロッパで季節性ウイルスのスプリットワクチンを用いて行われた第I/II相臨床試験のデータから、強い免疫応答と良好な忍容性が示されました。約940名の被験者を18~49歳と50歳以上の2群に分け、候補ワクチンの安全性と免疫原性を評価する多施設共同試験が計画されました。18~49歳の被験者集団ではその99.6%でH1N1型とH3N2型のウイルス株に対して防御効果のある抗体レベルが得られ、92.9%ではB型株に対する同様の抗体レベルが得られました。50歳以上の被験者集団ではその96.6%でH1N1型のウイルス株に対して防御効果のある抗体レベルが得られ、H3N2型に対しては100%、B型株に対しては73.3%の被験者で同様の抗体レベルが得られました。 要約従来の鶏卵を使用する技術と比較して、マイクロキャリアとVero細胞を使用してインフルエンザワクチンを製造する技術にはいくつかの利点があります。Vero細胞の培養スケールだけでなく、関連するウイルスの不活性化と精製の工程でもスケールの拡大に成功していることを示しました。Vero細胞のマスターセルバンクとワーキングセルバンクのシステムを使用すれば、接種材料の細胞を滞りなく準備できます。6000リットルのバイオリアクター複数個にスケールを拡大すると、パンデミック期のウイルスを一貫して高収率で製造することができるので、パンデミックウイルス変種株が出現しても迅速に対応することができます。 関連製品細胞培養用マイクロキャリア 細胞培養システム クロマトグラフィー担体
製造用クロマトグラフィーシステム 文献
お問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
© 2026 Cytiva