
|
||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
||||||||||||||||||||||||||||||||||||||||||||||
|
Location:Home > テクニカル情報配信サービス > ProteinSciences Club > DIGE定期便 |
||||||||||||||||||||||||||||||||||||||||||||||
DIGE定期便 第2号
|
||||||||||||||||||||||||||||||||||||||||||||||
| 蛍光色素 | 最大波長λ(nm) | Cy3を基準にした分子量差(Da) | ||
|---|---|---|---|---|
| 励起 | 検出 | Minimal Dyes | Saturation Dyes | |
| Cy2 | 491 | 509 | -32 | なし |
| Cy3 | 553 | 569 | 0 | 0 |
| Cy5 | 645 | 664 | -2 | +12 |
どちらのタイプも各蛍光色素間の分子量差はわずかであり、電荷も等しくなるよう設計されています。したがって、サンプルを異なる蛍光色素で標識しても、同一タンパク質の二次元電気泳動ゲル上における移動度は変わりません。また、もう一つの特長として各蛍光色素の励起/検出波長が隔離されています。適切な条件(励起光や検出フィルターなど)で蛍光検出を行うことで、検出時のクロストーク、すなわち異なるサンプルの重複検出が起こらないようになっています(表1)。
このようなCyDye™を用いることで、同一ゲルに泳動した複数サンプルからそれぞれ独立したイメージが得られ、詳細な比較解析を行うことができます。
2つの標識法はそれぞれ異なる特長がありますので、サンプルや実験系に合わせてお選びいただくことができます。

(補足イメージ)
左図: Controlサンプル(Cy3標識)/処理サンプル(Cy5標識)
右図: Controlサンプル(Cy5標識)/処理サンプル(Cy3標識)
2つのサンプルの標識を入れ替えたときの比較イメージです。蛍光標識を入れ替えても得られる結果は変わりません。
(北里大学理学部生体分子動力教室 大石正道先生 ご提供)
2. Minimal Labelling法 (ミニマルラベリング法)
~ どんなサンプルでもOK!その使いやすさが魅力 ~
 ミニマルラベリング法は、多くの研究者が用いている標準的な標識法です。ミニマルラベリングに用いるCyDye™ DIGE Fluor minimal dyes は、反応性NHSエステル基をもち、アミド架橋反応によりリジン(Lys)のイプシロン(ε)位のアミノ基に共有結合するようにデザインされています(図1参照)。名前の通り、最小限のタンパク質を標識して検出する方法であり、標識される割合は各タンパク質の全量に対して1~2%程度です。タンパク質中のリジン残基は中性もしくは酸性の状態で内在的に+1 に荷電していますが、CyDye™ DIGE Fluor minimal dyes も+1 に荷電しているため、タンパク質のpIを有意に変えることはありません。
ミニマルラベリング法は、多くの研究者が用いている標準的な標識法です。ミニマルラベリングに用いるCyDye™ DIGE Fluor minimal dyes は、反応性NHSエステル基をもち、アミド架橋反応によりリジン(Lys)のイプシロン(ε)位のアミノ基に共有結合するようにデザインされています(図1参照)。名前の通り、最小限のタンパク質を標識して検出する方法であり、標識される割合は各タンパク質の全量に対して1~2%程度です。タンパク質中のリジン残基は中性もしくは酸性の状態で内在的に+1 に荷電していますが、CyDye™ DIGE Fluor minimal dyes も+1 に荷電しているため、タンパク質のpIを有意に変えることはありません。
標識プロトコールは汎用性が高く、極端に異質なサンプルを除いてはどんなサンプルも同じ条件で扱うことができます。
検出感度は銀染色と同程度であり、各サンプルにつき約50μgのタンパク質があれば十分な比較解析結果が得られます。
さまざまな分子を対象とした報告がされていますが、一例としてリン酸化タンパク質の解析*1があります。一般的に、リン酸化による等電点の変化は約0.05といわれていますが、このような微細な変化であってもDIGE法で検出することができます。
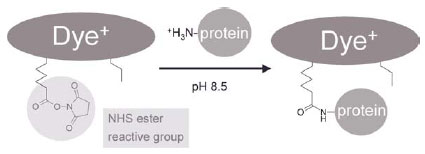
図1 ミニマルラベリングの標識機構
3. Saturation Labelling法 (サチュレーションラベリング法)
~ 一度使うとやめられない!? 高い検出感度が最大の魅力 ~
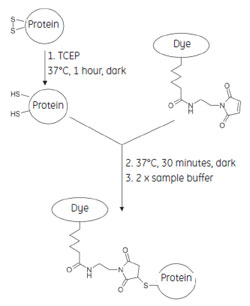
図2 サチュレーションラベリングの標識機構
サチュレーションラベリングに用いるCyDye™ DIGE Fluor saturation dyes はマレイミド反応基をもっており、チオエーテル結合により、タンパク質のシステイン残基のチオール基と共有結合するようデザインされています。
全タンパク質の一部を標識するミニマルラベリング法に対し、サチュレーションラベリング法ではサンプル中のタンパク質に含まれる全てのシステインを標識する点が異なります。標識されるCyDye™の数はタンパク質の種類によって異なるためそれぞれの検出感度は変化しますが、目安として銀染色の約10倍程度です。これにより、たった5μgのタンパク質から4000個以上のスポットを検出することができます*2。何らかの要因でわずかなタンパク質量しか抽出できないサンプルなど、これまで解析が困難であった微量サンプルを解析対象にできることが大きなメリットです。また、検出されたタンパク質スポットをそのまま切り出し、MS解析によるタンパク質同定を行うことができます。(タンパク質同定までの詳細は後編でご紹介いたしますので、お楽しみに。)
原理上、システインを含まないタンパク質は検出できませんので、サンプルによっては使用に向かない場合もあります。(参考までに、データベース上にあるヒト遺伝子から予測される発現タンパク質では、約9割のタンパク質にはシステインが含まれているようです。)また、サンプルに含まれるシステインの数が極端に多い・少ない場合には、標識プロトコールの最適化を行う必要があります。
サチュレーションラベリング法のもつ高い検出感度は、他のゲル染色手法では検出することができなかったタンパク質を検出し、発現差異解析を可能にします。論文の内容などから判断すると、現在サチュレーションラベルを使っている研究者の割合は全ユーザーのうち10%程度にとどまっています。しかし、そのユニークな特長から、サチュレーションラベリング法を用いた報告も徐々に増えてきています。4. 2つの標識法の比較
2つの手法の性質について簡単にまとめました(表2)。多くの場合はミニマルラベリングでの解析で十分な結果が得られます。サンプルに限りがある場合など、何らかの要因で検出感度を求める場合には、サチュレーションラベリングでの解析が適しています。したがって、解析したいサンプルによって使い分けることができます。標識の違いにより、同サンプルのミニマルラベリングした泳動パターンとサチュレーションラベリングした泳動パターンは異なります。どちらが解析対象に適しているかを十分検討し標識法を選択しましょう。
| 項目 | ミニマルラベリング法 | サチュレーションラベリング法 |
|---|---|---|
| 検出感度 | 銀染色と同等 (0.1~0.5 ng) |
銀染色の約10倍 (0.01~0.05 ng) |
| 解析時の添加サンプル量 | 50 μg | 5 μg |
| CyDye™の種類 | 3種類 (Cy2/Cy3/Cy5) | 2種類 (Cy3/Cy5) |
| 修飾部位 | Lys, ε-アミノ基 | Cys, チオール基 |
| 標識プロトコール | 時間:約45分で終了 ほとんどのサンプルは推奨プロトコールで対応可能 |
時間:約90分で終了 サンプルに応じて最適化が必要な場合あり |
| 等電点電気泳動後の システイン還元アルキル化 |
DTT、ヨードアセトアミド処理 | DTT処理のみ |
まとめ
- DIGE用のCyDye™は分子量や電荷の差がなく、標識色素による移動度のズレは起こりません。
- ミニマルラベリング法は最小限のタンパク質を標識して検出する手法で、一般的に多くの研究者が用いています。
- サチュレーションラベリング法は存在する全てのシステインを標識する手法であり、銀染色の約10倍の検出感度を持つことが特長です。
※後編では、それぞれの標識法に対応したタンパク質同定プロセスをご紹介します。
○ 文献リスト
お問合せフォーム
※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。
お問い合わせありがとうございます。
後ほど担当者よりご連絡させていただきます。
© 2026 Cytiva

