|
||
|---|---|---|
|
|
||
|
Location:Home > テクニカル情報配信サービス > Pure Protein Club |
||
限外ろ過膜を用いた封入体のリフォールディング昨今のタンパク質機能・構造解析において、機能を保った組換えタンパク質を必要純度、必要量用意することが第一ステップとなります。前号では生体機能で重要な役割を果たしている膜タンパク質について、精製ポイントの一つを紹介しました。本号では膜タンパク質と並び、精製が難しいとされる封入体からの精製、特に再生(リフォールディング)について紹介します。 封入体とは大腸菌などの宿主にとって、組換えタンパク質は本来発現されない「異物」です。この異物が細胞質内へ過剰発現される時に、発現量、発現速度、タンパク質の性質によっては封入体と呼ばれる不溶性の凝集体を形成することがあります。 封入体からタンパク質を回収する際の利点としては、
といった点があり、大量に組換えタンパク質を必要とし、再生方法が確立されている場合には意図的に封入体として発現させる場合もあります。 その反面、注意点としては、
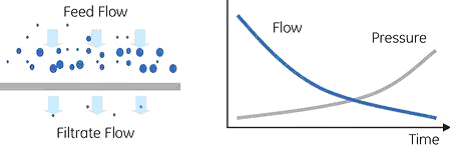
といった点もあり、一般的には培養に戻り、可溶性発現の方法を模索します。 封入体からの精製発現系を検討してもどうしても封入体を形成する場合は、封入体からの精製が必要になります。 ポイント1:可溶化変性剤を用いて可溶化させます。一般的には8Mウレアや6M塩酸グアニジンのような強度の条件下で変性させます。封入体が形成される際、本来のS-S結合とは異なる部位で結合をすることがあります。変性剤だけでは可溶化されない場合には還元剤(DTTや2-メルカプトエタノール)を添加することもあります。 ポイント2:再生一般的に透析や希釈による再生(リフォールディング)方法が用いられます。またカラムを用いた再生方法の検討例もあります。His-tagタンパク質の場合は、変性状態でHisTrap™カラムなどの金属キレートカラムへ結合させ、カラム内で再生させる方法を以前ご紹介しました。 カラム内での再生方法は透析や希釈による再生方法と比べて濃縮効果が期待できる一方、カラム内で再凝集の確認が行いにくい点、またタンパク質濃度が高くなると凝集しやすいサンプルでは注意が必要になります。 今回は新たなアプローチとして限外ろ過膜を用いた再生方法をご紹介します。 限外ろ過について限外ろ過では、膜表面のポアサイズによる分子量分画で、加圧や遠心などにより、ポアサイズに対して低分子側の物質を膜面で透過させ、高分子側の物質を膜表面上で透過阻止させる方法です。このろ過により目的サンプルが濃縮もしくは清澄化されます。 ろ過方法には大きく分けて2種類あります。 デッドエンドろ過ディスクタイプのフィルターに代表されるような、膜表面に高分子側物質を堆積させながらろ過する方法です。未ろ過(阻止された)サンプルは膜表面に堆積され、目詰まりしやすくなるため、ディスポーザブル使用が一般的です。
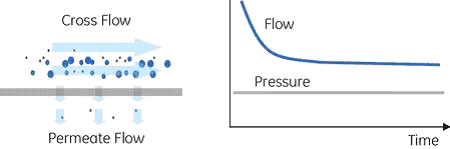
クロスフローろ過溶液が筒状の膜(ホローファイバー)またはシート状の膜(フラットシート)に挟まれた部分を通過します。送液時に背圧が生じることで、低分子側の物質が膜部分から透過されます。高分子側の物質はそのまま未ろ過側の出口から流れ出るため、膜表面に堆積しにくい特徴があります。また全ての低分子側物質が一度の膜表面接触で透過されるわけではないため、繰り返し膜部分を通液させることで徐々に低分子側物質を透過することができます。
限外ろ過膜による再生変性サンプル溶液には大きく分けて
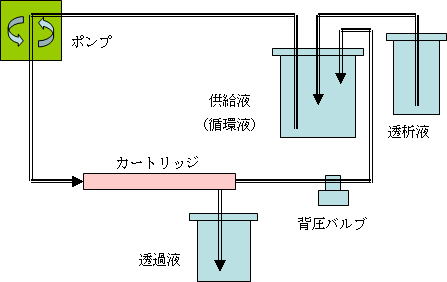
が混在しています。再生のポイントは一気に変性剤を除去するのではなく、徐々に変性剤濃度を低くすることです。透析膜を用いた場合は浸透圧の差により、徐々に変性剤を除去することが可能ですが、透析液が透析膜内部へ入るため、どうしても液量が増えてしまいます。クロスフローろ過では流量と背圧を調整することで、濃縮速度やろ過される透過流量を制御することができます。培養細胞上精からのサンプル濃縮であれば、流量を上げたり、背圧を高めたりすることで比較的短い時間でサンプルの濃縮ができますが、変性タンパク質を再生する場合はあえて時間をかけた(流量や背圧を抑えた)ろ過を行います。 MidJetシステムやQuixStandシステムでは流量や背圧の制御が可能で、また透析液を用いることでサンプルの溶液置換も容易に行うことができます。
膜選択のポイント処理液の量にもよりますが、100 ml程度であればMidGee™カートリッジかKvick Start™カセットが適しています。メンブレンのポアサイズは目的サンプルの分子量に対して1/3程度のものを選択してください。ポアサイズが大きくなると目的分子が透過されやすくなり、反対に小さくなると目詰まりによりろ過効率が低下しやすくなります。スケールアップ時には処理液量にあわせて膜面積を増やしますが、ろ過条件を反映しやすくするためにポアサイズは同じものを用います。 ホローファイバーとフラットシートのいずれもサンプルを濃縮させる限外ろ過での使用が可能です。フラットシートの方が構造的に比較的短い時間でのろ過濃縮が可能です。ホローファイバーは目詰まりしやすい分子が処理液中に含まれている場合に有効です。特にウイルス粒子など巨大分子の濃縮にはルーメン径が太めのカートリッジを選択します。細いルーメン径では膜面積が広くなるので、処理時間を優先する場合は、ルーメン径を細くします。 最後に再生方法には王道はありませんが、引き出しの数が多いほど、「いざ」という時に対処しやすくなります。効率改善を検討されている方は、一度試してみてはいかがでしょうか。 関連ページお問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
||
© 2026 Cytiva