東京都立大学名誉教授 奥山 典生先生
探日録 第8回:カルモジュリン~学会へのデビューから教科書の住人へ~《前編》
1)発端 ― 研究のはじまり
この表題を簡単にいうと、「ひとつの名もないタンパク質が研究対象として取り上げられ、学会に発表され、名前がつけられ、多くの人々の注意を引くようになり、その結果として一般的な教科書にも記述されるようになった」という物語です。この物語に私がどう関わったかをお話しします。
1970年ごろ、私は脳に特異的なタンパク質(S100タンパク質)を研究するにあたり、対照タンパク質としてこのタンパク質に目を付けました。このS100タンパク質の精製は非常に難しいと評判でした(これについては、次回記述します)。一方、その対照として選んだタンパク質は、電気泳動ではS100とほとんど同じ移動度を示し、さまざまな組織に普遍的に存在するもので、特に名前はありませんでした。私は電気泳動のバンドの様子から見て、取り扱いやすいタンパク質ではないかと考えました。
その当時、私たちの研究室は出来てからの日も浅く、研究の中心は4年生の卒業研究でした。そこで、既知のタンパク質を用いて実験条件を検討しながら実験者の腕前を量り、結果を見ながらその手法を目的のタンパク質に適用していくという進め方をしました。これは以前、私が魚のインスリンの研究に用いた方法です。まず、既知のウシのインスリンで実験を行い、その結果を参考にして魚のインスリンの分析と操作を行うというものでした。この方法は極めて有効でしが、ウシのインスリンは自在に結晶化できましたが、魚のインスリンはついに結晶になることはありませんでした。当時、魚のインスリンは球晶にしかならないといわれていましたが、後にこの様なサンプルには数種類のインスリンが混合されていることが解りました。遠洋魚業の漁師さんが「マグロ」と称される数種の魚のスタニウス小体を混ぜてしまっていたことが解ったのです。
2)ウシ脳の酸性タンパク質の大量生産法
大学紛争のころ(1965年)、私たちの研究室に7人の卒研生が来ました。基礎的な訓練が出来ていないのに、高邁な理屈だけを喋る人々でした。彼らの研究対象は、電気泳動で検出される酸性の強い3つのバンド―S100由来の2種と対照タンパク質(後のカルモジュリン)―にしましたが、この対照タンパク質はこの時点では、単に“脳の酸性タンパク質”というほかありませんでした。
この当時(1956年)、H. A. Soberらが既にDEAEセルロースの合成法をAmerican Chemical Societyに発表し、タンパク質分離に対する有効性を示していました。私たちも日本で初めてそれを合成し、その有効性を確かめるとともに、いくつかの研究室にそのイオン交換体を提供したりもしていました。
その後(1959年)、私が米国マサチューセッツ州のWorcester Foundationで研究をしているときSoberさんがやって来て、私が低温室で動かしているクロマトグラフィー装置を見ながら寒い中でいろいろと議論をしたことを覚えています。一方で、その当時、米国ミズーリ州にあるWashington UniversityのBlake Moore(薬剤師)はDEAEセルロースを用いた肝臓、脳などの全部のタンパク質の分離の可能性をアメリカのFederation Meetingで発表していました。彼らは、すべてのタンパク質に番号を付けることを試みており、S100はその時の名称です。その何年か後に彼の研究室を訪問した際、そこに自動クロマトグラフィーの装置はありましたが、研究室の設備と人員とを見てそれ以上の研究は進められそうにないと感じたのを覚えています。
一方、私たちの研究室は研究費も少なく、自動クロマトグラフィーの装置もなく、十分な経験を積んでいるともいえませんでしたが、優秀な学生と気力がありました。毎年、学生の教育や訓練を兼ねて、タンパク質の大量生産を行ったわけです。年々、少しずつ操作条件に改変を加えながら作り上げたのが図1になります。
図1. ウシ脳の可溶性タンパク質のDEAEセファデックス
クロマトグラフィー
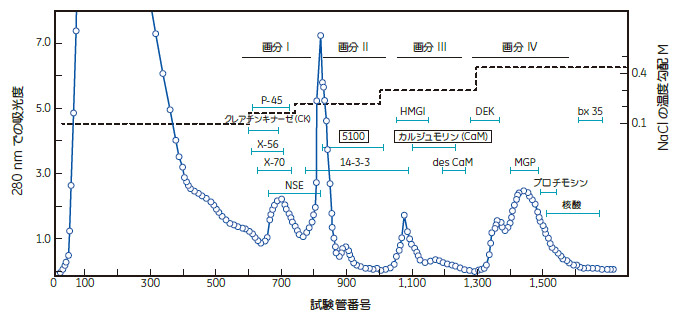
カラム:DEAEセファデックスA-50 8.5 cmφX25 cm
溶離緩衝液:0.1 Mリン酸カリウム(pH7.1)、1 mM EDTA
NaCl 0.1M—0.4M)マルチ―イソクラチック法
流速:線速度3 cm/毎時
試料:ウシ脳(40 Kg)からの抽出物(170 g)
この対照タンパク質(後のカルモジュリン)を担当させられた学生は不満気でした。どこの組織にも普遍的に存在する名もないタンパク質を(誰も研究はしていないといいながら)研究しろというのですから、意気に燃えている学生にして見れば、当然といえば当然でしょう。しかし私は、このタンパク質は電気泳動の挙動やバンドの形状から見て、実験経験の少ない学生にも精製しやすく、数年の内に誰かが研究を始めるとの予想から、学生の訓練には最適だと考えていました。この精製に要するクロマトグラフィー系はかなり大がかりで、溶離液の量も数百リットルから千リットルにもなりました。分取された画分についてタンパク濃度分析、電気泳動による純度分析などもあり、大変な作業でした。4月から始めて7月位までかかり、精神的にもかなりの緊張感を伴う研究となりました。
この頃、このタンパク質について、日本生化学会などで「脳に存在する酸性の強いタンパク質」として発表をはじめました。また、フェニルアラニンの含量が多いので、“Phe-Rich-Protein”とも呼んでいました。何年かのちに(1960年代の終わりの頃)、アミノ酸配列分析などが進んだ頃、大阪大学医学部の垣内史朗さんのデータに出会うことになりました。垣内さん達の研究は、「リン酸化酵素の活性化に関わる因子が存在し、それはカルシウムによって活性化される」というものでした。その因子は微量でしか存在しないと考えられており、まだ十分に精製されていなかったこともあり、新しいホルモンのようなものではないかと考えられていました。私は学会でその話を聞いて、「これは、私たちが精製し、構造を解析しているタンパク質と同一ではないか」と思いました。垣内さんは大阪大学の所属で、学部は異なりましたが私と同期生でもありましたので、私たちのタンパク質の活性試験を依頼しました。その結果は私たちのタンパク質サンプルが極めて高活性であることが解りました。その結果、私たちの「Phe-Rich-Protein」はCalcium Modulated Proteinであり、一方、私たちの研究ではさまざまな組織内にかなり多量に存在することが解っていましたのでホルモンの可能性は否定されました。私の所から大量にタンパク質を提供したことで、その研究は非常に進みました。その研究結果が、日高弘義、垣内史朗著「カルモデュリン―Ca2+受容蛋白質」(1981)の単行本の出版となり、さらに、垣内さんはこの研究で1988年(昭和58年)に朝日賞を受賞されました。しかし、受賞のテーマが「カルモジュリンとカルモジュリン結合タンパク質の発見」であったことから、彼は私と会うたびに、ぼそぼそと言い訳をしてくれました。一方で、この研究は米国テネシー州のSt. Jude Children’s HospitalのW. Y. Cheung教授と激しい先陣争いを繰り広げていました。結果は、上記のように日本側の勝ちとなったのですが、Cheung教授はそのタンパク質にカルモジュリン(Calcium modulated Protein(in))(CaM)という名前を付けていました。垣内さんも色々考えたうえでそれに従いました。
その後Cheung教授は「Calcium and Cell Function」7巻(1980-1987)の編集をしてその地歩をかためましたが、研究のうえでは次第に後退していきます。余談ですが、彼は米国フィラデルフィア大学のJohnson研究所のB. Chance教授の教え子で、この研究所には私の研究室出身の足立和夫教授がいます。NADHオキシダーゼの結晶化(Malcolm Dixon著「Enzyme」(1987)にその結晶の写真が出ています)の研究を認められた結果です。その後、北海道大学の矢沢さん達はtetrahymenaからカルモジュリンの簡便な抽出法を工夫し、構造決定などを行いました。現在では精製の標準法は逆相の高速液体クロマトグラフィーになっていますが、私たちはこの様な方法は特別な場合以外にはあまり用いませんでした。サンプルを凍らせることもあまりしませんでした。タンパク質の高次構造は一度変化させると元へ戻らなくなることがあるからです。
このように始まった“脳の酸性タンパク質”の研究ですが、この後の展開は次回紹介しましょう。

東京都立大学名誉教授 奥山 典生先生
1957年 東京都立大学理学部化学科 助手
1959年 東京都立大学理学部化学科 助教授
1973年 東京都立大学 教授(理学部 生物化学講座 担当)
1991年 東京都立大学 退職 名誉教授
1991年 神奈川歯科大学 教授(歯科生体工学講座 担当)
1996年 神奈川歯科大学 退職
現在 バイオテクノロジー標準化支援協会NPO 理事長

