細胞膜表面タンパク質の選択標識によるディファレンシャル解析
細胞膜表面タンパク質は、タンパク質-タンパク質間の相互作用(シグナル伝達、環境適応、薬剤処理への応答など)の多くに関連していますが、疎水性であることや、発現量自体が少ないこと、高分子量であるという性質から、二次元電気泳動ではしばしば検出が困難といわれてきました。
ここでは、2D-DIGE(2 Dimensional Fluorescence Difference Gel Electrophoresis)を用いた膜表面タンパク質のディファレンシャル解析法をご紹介します。新しくシンプルな蛍光標識プロトコールを用いて膜表面タンパク質のみを標識することで、分画の必要なしに解析をすすめることができます。
※2D-DIGEの実験手法別製品・技術情報ページ (技術の詳細はこちらをご確認ください)
細胞膜表面タンパク質の選択標識ワークフロー
通常のプロトコール(図1、2 Standard Ettan™ DIGE protocol)では、まず細胞ライセートを調製、標識した後、膜画分を用いることが一般的です。
これに対し、新しい標識プロトコール(図1、1. Cell-surface protein labeling protocol)では、細胞ライセートを調製する前に蛍光標識操作を行います。細胞構造を壊さないまま標識操作を行うことで、膜表面タンパク質を選択的に標識できるように工夫されています。
※最下部の詳細にワークフロー動画のリンクがあります。
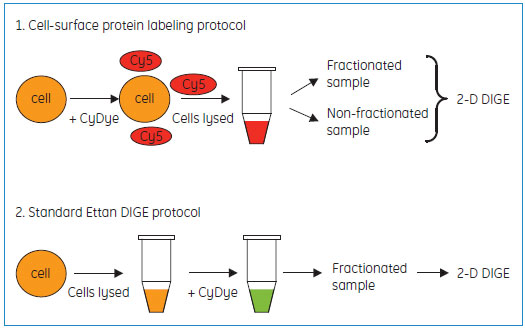
図1 標識ワークフローの比較
上:細胞表面タンパク質の選択標識プロトコール
下:一般的な膜タンパク質解析用におけるDIGEプロトコール
膜表面タンパク質が選択的に標識されており、分画の必要はありません
実際に細胞膜表面のタンパク質が選択的に標識されているかを確認した結果が図2です。CHO-K1細胞をサンプルとして、ぞれぞれ分画前(左)、膜画分(中央)、細胞質画分(右)の3種のサンプルを二次元電気泳動で展開しました。ゲルごとに、標識されたタンパク質を示すCy3イメージ(A:上段)と、泳動された全タンパク質を示す銀染色イメージ(B:下段)の両方を示しています。
分画前のサンプルと膜画分サンプルにおけるCy3標識タンパク質の分離イメージには(A段の左、A段の中央)、大きな違いはありませんでした。このことは、膜表面タンパク質標識のプロトコールを用いた場合には、分画操作が必要ないことを示しています。
また、細胞質画分にはCy3標識タンパク質が存在していないことが示されており(A段の右)、膜表面のタンパク質が選択的に標識されていることがわかります。
※銀染色イメージより、タンパク質の分離には問題がないことを確認しています。

図2 細胞膜表面タンパク質が選択的に標識されている様子
左:分画前、中央:膜画分、右:細胞質画分
A(上段):Cy3イメージ B(下段):銀染色イメージ ※同じゲルからの取得イメージ
サンプル:CHO-K1細胞
膜表面タンパク質を効率的に解析できます
膜表面タンパク質標識プロトコール(図1、上)で調製したサンプルと、一般標識プロトコールから調製した膜画分サンプル(図1、下)について、二次元電気泳動で比較したイメージが図3です。膜表面標識プロトコール調製サンプルに特異的なスポットを赤で、一般プロトコール膜画分サンプルに特異的なスポットを緑で示しています。(双方に存在するスポットは、色が重なり合って黄色にみえます)
この結果より、双方の方法で調製されたサンプルに含まれるタンパク質(の割合)は異なることがわかります。この要因のひとつとして、膜分画サンプルには内膜由来のタンパク質(ER、ゴルジ体、ミトコンドリア、核など)が含まれていることが予測されます。外膜に露出しているタンパク質を効率的に解析するには、新しい膜表面標識プロトコールが適していることがわかります。実際にこの実験例では、このプロトコールから調製されたサンプルからのみ検出されたスポット(赤で示されているもの)が、80個以上見つかりました。これは、全スポットの10%程度にあたります。

図3 膜表面標識プロトコールと一般プロトコール(膜画分)による2D-DIGEパターンの比較
赤:膜表面標識プロトコールから調製されたサンプル、緑:一般プロトコールから調製された膜画分サンプル
※サンプル:CHO-K1細胞
関連リンク
このページの先頭に戻る
2D-DIGEの実験手法別製品・技術情報ページ
DIGE道場 トップページ




