ゲルろ過クロマトグラフィーを用いた
膜タンパク質の安定性評価
P. Moberg1, M. Burstedt1, P. Nordlund1, L. Haneskog2, and C. Löw1
1 Department of Medical Biochemistry and Biophysics, Karolinska Institute, Stockholm, Sweden
2 Cytiva Bio-Sciences AB, Uppsala, Sweden
タンパク質を結晶構造解析に用いる場合、サイズが均一で長時間にわたり立体構造が保たれたタンパク質の調製が必要です。また、内在性膜タンパク質(IMP)を精製するには、界面活性剤を用いた可溶化が必須ですが、この場合立体構造が失われる、タンパク質の活性が低くなることがあります。ここではゲルろ過クロマトグラフィーを用いた、タンパク質の安定性と内在性膜タンパク質の凍結融解による影響の評価についてご説明します。
はじめに
長年の研究にもかかわらず、結晶構造解析用の膜タンパク質結晶を得る決定的な方法はまだ存在しません。一般に、膜タンパク質結晶を調製する条件について広範なスクリーニングと最適化が必要と考えられています。結晶構造解析に用いるためには、純度が高くサイズが均一な膜タンパク質を調製しなくてはなりません。
大半のラボにおいて、ヒスチジンタグ膜タンパク質の精製は2段階で行われています。最初のステップでは、界面活性剤で可溶化したタンパク質を固定化金属イオンアフィニティークロマトグラフィー(IMAC)に吸着させ、大半の不純物を除去します。次のステップでは、ゲルろ過(GF)で残存不純物を除去するほか、多量体および凝集体を形成している不要な形態の目的タンパク質を除去します。サイズが均一な内在性膜タンパク質(IMP)を得るために広範囲の界面活性剤およびバッファー条件(pH、塩、添加剤)についてスクリーニングを行います。このスクリーニングにはGFが適しています(1)。しかし、この方法では、純度が高くサイズが均一なタンパク質を得ることができても、精製したタンパク質の立体構造が長期的に保たれるとは限りません。
集菌からタンパク質精製を経て結晶化を開始するまでのすべてのステップを1日で行うのが理想的ですが、1日で終わらないことが多く、単離したタンパク質を低温室や氷上で保存するか、凍結させた後に解凍することがあります。しかし、このように凍結融解を行うと氷の結晶が形成され、バッファー中の塩やタンパク質の濃度が上昇するため、この操作はタンパク質の安定性に大きく影響することがあります(2)。タンパク質損傷のリスクを最小限に抑えるために、たとえばグリセロール(5%~10%)を添加して少量ずつ分注し、できれば液体窒素で瞬間凍結するといった予防措置が必要です。なお、リン酸バッファー中で凍結させると、塩基性成分の沈殿によりpHが低下することがあるため、トリスバッファーの添加が有用です。
結晶構造解析にタンパク質を用いる前に、0~4℃での保存や凍結融解によるタンパク質への影響を評価することをおすすめします。GFは、タンパク質の均一性を評価するための有効な手段です。溶出ピークが対称的でシャープであれば、正しくフォールディングされた均一なタンパク質が調製されたことを示します。
ここでは、長期保存および凍結融解の影響をGFで評価した例を示します。Superdex™ 200 5/150 GL(カラム容量3 ml)を用いて、ÄKTA™microクロマトグラフィーシステムでGFによる分析を行いました。なお、25 μlのサンプルをオートサンプラーで自動注入し、流速0.25 ml/minで分離できるため、1サンプルの分離には12分間しかかかりません。
タンパク質の発現と精製
N末端に6ヒスチジンタグを有するIMPを、E.coli C41(DE3)細胞を用いて、20℃で20時間発現させました。高圧ホモジナイザー(Avestin)で細胞を破砕し、100,000×gで1時間、超遠心分離にかけ細胞膜を回収しました。細胞膜を可溶化バッファー(Sバッファー:300 mM NaCl、20 mMイミダゾール、5% グリセロールを含むpH 7.5の20 mMリン酸ナトリウムバッファー)に再懸濁した後、1%のn-ドデシルβ-D-マルトシド(DDM)の存在下で撹拌しながら1時間、4℃で可溶化しました。その後、4℃、100,000×gで15分間超遠心分離にかけ、非可溶化物質を除去しました。低温室で30分間上下転倒混和させ、Ni Sepharose™ 6 Fast Flow担体へのバッチ吸着を行いました。このクロマトグラフィー担体をカラム内径10 mmの自然落下用オープンカラムに充填しました。
20 mMのイミダゾール(カラム体積[CV]の10倍量)および45 mMのイミダゾール(20 CV)を用いて非特異的吸着分子を洗浄した後、500 mMのイミダゾール(5 CV)で溶出を行いました。これらのイミダゾール溶液はすべて0.03%のDDMを添加したSバッファーで調製しました。この溶出液5 mlをHiLoad™ 16/60 Superdex™ 200 pgゲルろ過カラムに添加し、イミダゾールを含まず0.03%のDDMを添加したバッファーを流速1 ml/minで流し、精製しました。
長時間安定性試験
上述のように試製したサンプル(1 mg/ml)から50 μlを分取し、低温室で10日間保存しました。保存したサンプルを、保存後1日、7日、10日に5 μlずつ分取し、150 mM NaCl、5%グリセロール、0.03% DDMを含むpH 7.5の20 mM HEPESバッファー45 μlで希釈し、そのうち25 μlを直ちにGFで分析しました。なお、保存したサンプル中の沈殿物を除去するために、あらかじめ低温室で20,000×gで5分間、遠心分離を行ってからGFに添加しています。
凍結融解試験
前述の手順で精製したタンパク質溶液50 μlをそれぞれ異なる方法で凍結融解しました。サンプル1は凍結せず、サンプル2は-20℃で一晩凍結、サンプル3は-80℃の液体窒素中で凍結し24時間保存しました。各サンプルを4℃で1時間インキュベートして解凍し、20,000×gで5分間遠心分離した後、長期間安定性試験と同じ方法でGFにて分析しました。
結果
サンプルとして原核生物のT2チャネル2を用い、4℃で保存した後、保存後0日、1日、7日、10日のサンプルを用いてGFによる分析を行いました(図1)。保存していないタンパク質は単一のピークを示していますが、保存後1日のデータでは、小さいボイドピークが現れました。保存時間が長くなるにつれ新鮮なタンパク質に比べGFピークが低く広くなったことから、タンパク質の凝集が起こり、タンパク質の均一性が劇的に低下したことがわかります。
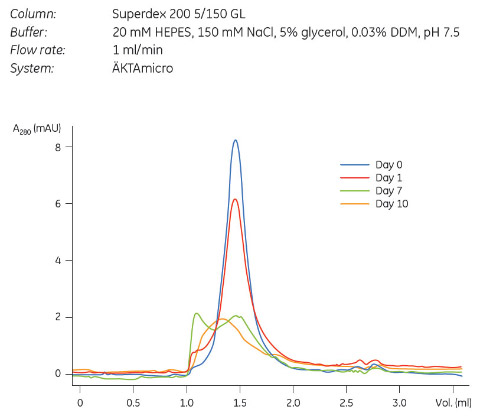
図1 原核生物T2チャネル2-(His)6
の4℃保存による安定性。保存後0、1、7、10日にGFによる分析を行いました。保存期間が長くなるにつれ、ピークが低く広くなったことから、タンパク質の均一性が低下したことがわかります。1日以上保存すると、1 ml付近にボイドピークが現れますが、これはタンパク質が凝集したことを示しています。
-20℃でゆっくりと凍結したサンプル(赤色の曲線)または液体窒素中での瞬間凍結したサンプル(緑色の曲線)、非凍結サンプル(青色の曲線)をGFで比較した結果、瞬間凍結の重要性が明らかになりました(図2)。5%グリセロールの存在下で-20℃でゆっくりと解凍した場合、サンプルは完全に沈殿しました。
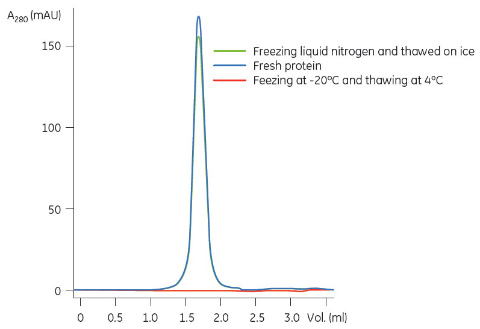
図2 凍結融解方法の違いによるGFパターンの相違。サンプルは原核生物のIMPで、界面活性剤により可溶化したものです。図1と同じ条件でGFによる分析を行いました。新鮮なタンパク質(青)、液体窒素で瞬間凍結し氷上で解凍したタンパク質(緑)および-20℃で凍結し4℃で解凍したタンパク質(赤、ピークなし)
結論
このように、GFによる分析で、保存時間または凍結融解の方法がIMPの安定性と均一性にどのように影響するかがわかります。Superdex™ 200 5/150 GLカラムを使用すると分析時間が短縮されるため、IMPの品質管理を迅速に行え、サンプル、バッファーおよび界面活性剤の消費量を抑えられます。
References
- C. Löw, et al. Rapid buffer scouting and quality control of integral membrane proteins. Discovery Matters 12, 10–11 (2010).
- K. A. Pikal-Cleland et al. Protein denaturation during freezing and thawing in phosphate buffer systems: monomeric and tetrameric beta-galactosidase. Arch. Biochem. Biophys. 384, 398–406 (2000).

