Capto™ Sの添加条件のスクリーニングおよび至適化
はじめに
組換えタンパク質の発現レベルが高くなり、また生産性およびプロセス全体としての経済性改善の必要性から、バイオ医薬品業界向けの次世代クロマトグラフィー担体に対する需要がますます高まっています。イオン交換担体の容量とマストランスファー(物質移動)特性を大きく改善する技術としては、デキストランなどのsurface extenderを用いて多孔性ベースマトリックスを修飾する方法があります。新しい陽イオン交換担体であるCapto™ Sの開発にはこの技術が用いられ、dextran surface extenderを持たない陽イオン交換体と比べ結合容量が大きく向上しました。
Capto™ Sは新しいHigh Flow Agaroseプラットフォームを採用したクロマトグラフィー担体です。この担体は剛性が高いことに加え、高い動的結合容量(DBC)と速やかなマストランスファー特性を兼ね備え、より迅速な精製、より自由度の高いプロセスデザイン、コスト効率の最大化を実現します[1]。このプラットフォームを用いた製品は、Capto™ Q、Capto™ MMC、MabSelect™シリーズがあります。Capto™ Sは、組換えタンパク質の初期精製および中間精製、ならびにモノクローナル抗体精製の第2ステップ用に設計された強陽イオン交換体です。
Capto™ Sの性能を最大限に引き出すために、添加パラメーター、電気伝導度、pHを十分にスクリーニングする方法をご紹介します。また、推奨の逐次アプローチや実験計画法を用いたスクリーニング法について示し、考察しています。
Capto™ Sのデザイン
Capto™ Sの模式図を図1に示します。High Flow AgaroseベースマトリックスはSepharose™のベースマトリックスに比べ、非常に高い剛性を持ちます。dextran surface extenderによって平衡容量およびマストランスファー速度を増加し、DBCが向上します。リガンドのスルホエチル基は、強陽イオン交換基です。High Flow Agaroseベースマトリックスにより、図2に示すCapto™ Sの優れた圧力/流速特性を実現します。

図1. Capto™ Sの模式図
Capto™ Sはデキストランで修飾したHigh Flow Agaroseをベースマトリックスとし、最適な剛性、結合容量、マストランスファー特性を有する強陽イオン交換担体。
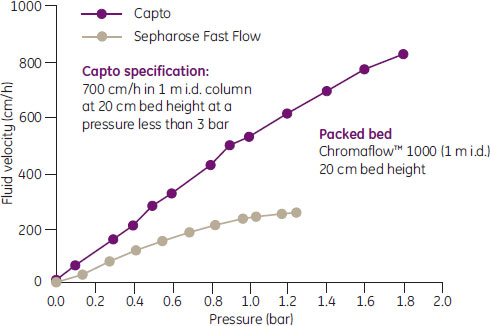
図2. Capto™およびSepharose™ Fast Flowの操作流速と圧力損失の関係
カラム内径:1m
ベッド高:20 cm
Capto™ 仕様:線流速 700 cm/h (3 bar以下)
Capto™ Sの主な長所の1つとして、大量スケールのプロセスデザインの自由度が高い点が挙げられます。図3の塗りつぶし部分で示されるように、Capto™担体の「操作範囲」はSepharose™担体よりも非常に広くなります。Capto™担体とSepharose™担体の粒子径および微細孔径は近いにもかかわらず、流速、ベッド高、サンプル粘度に関する操作範囲はCapto™ Sの方が広くなります。1 m径カラム、ベッド高20 cmの場合、Capto™担体では700 cm/hまで直線的な流速が得られるのに対して、Sepharose™担体ではこのスケールにおいて約250 cm/hまでとなります。ベッド高 40 cmの場合でも、Capto™担体では300 cm/hを超える流速が得られます。
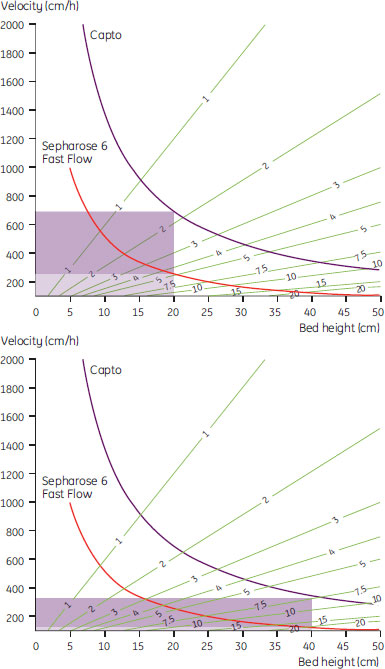
図3. Capto™およびSepharose™ Fast Flowの操作流速とベッド高の関係
青線:Capto™ Sベースマトリックスの限界圧(カラムおよびシステムの最大圧力に依存)
赤線:Sepharose™ 6 Fast Flowベースマトリックスの限界圧(ベースマトリックスの圧縮性に関係)
緑線:流速とベッド高から計算した滞留時間
塗りつぶし部分:Capto™の操作範囲がSepharose™ 6 Fast Flowよりも非常に広いことを提示
(上:ベッド高20 cm、下:ベッド高 40 cm)
dextran surface extenderは、内部にタンパク質が結合できる三次元格子を形成することにより平衡容量を向上させます。また、dextran surface extenderはイオン交換クロマトグラフィーにおけるマストランスファーも促進します。図4では、dextran surface extenderを有すCapto™ SのDBCが、surface extenderを持たないSP Sepharose™ Fast Flowに比べて高いことを示しています。
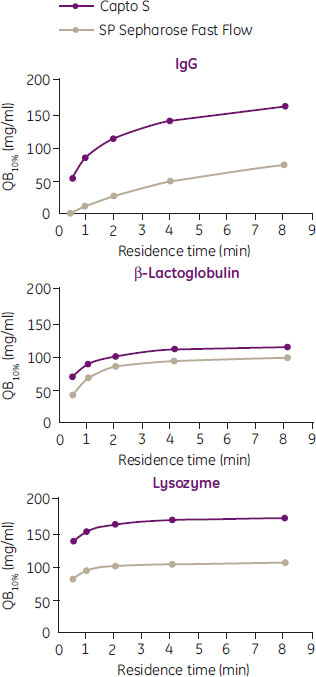
図4. 10% breakthroughにおける動的結合容量(QB10%)と滞留時間との関係
添加条件のスクリーニングおよび至適化
pHおよび電気伝導度が動的結合容量におよぼす影響
通常イオン交換体のDBCは電気伝導度が低いときに最大となり、サンプルの電気伝導度が上昇するとDBCは低下します(図5の赤線)。Capto™ Sにおいても、ほとんどのタンパク質がこのような従来型の挙動を示し、SP Sepharose™ Fast Flowよりも結合容量は高くなることが予想されます(図5青線)。しかしタンパク質によっては、Capto™ Sで精製した場合、従来型の挙動を示さないことがあります(図5緑線)。この従来型と異なる挙動の特徴は、電気伝導度を上昇させたときにDBCが最大になるピークがある点です。これはつまり、Capto™ SのDBCを十分引き出す条件を見出すには、種々の電気伝導度についてのスクリーニングが必要であることを意味します。
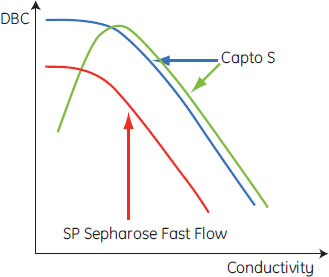
図5. Capto™ SおよびSP Sepharose™ Fast FlowにおけるDBC/電気伝導度曲線
従来型(赤線:SP Sepharose™ Fast Flow、青線:Capto™ S)および非従来型(緑線:Capto™ S)
滴定曲線(図6A)に示すようにタンパク質の電荷の総和はpHに依存することから、電気伝導度だけでなく、サンプル添加時の溶液のpHもまた結果に影響します。低いpHではタンパク質は強い正電荷を帯び、高いpH(タンパク質の等電点に近い値)では正電荷は弱くなります。従来型の挙動を示すタンパク質の場合には、DBCの観点からみた耐塩性は、高pHよりも低pHにおいて優れています(図6B)。非従来型の挙動を示すタンパク質の場合には、高pH(タンパク質の総電荷が弱いとき)におけるよりも低pH(タンパク質の総電荷が強いとき)の方が、最適なDBCを与える電気伝導度が高くなります(図6C)。
図7は実際のDBC/電気伝導度曲線で、α-キモトリプシンは従来型の挙動、コンアルブミンは非従来型の挙動を示しています。
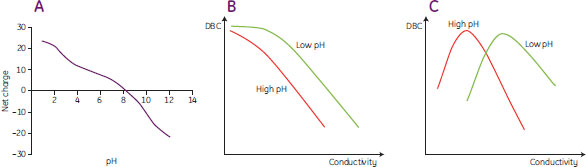
図6. 一般的なタンパク質の滴定曲線(A)およびpHがDBC/電気伝導度曲線に及ぼす影響
(B):従来型の挙動、(C):非従来型の挙動
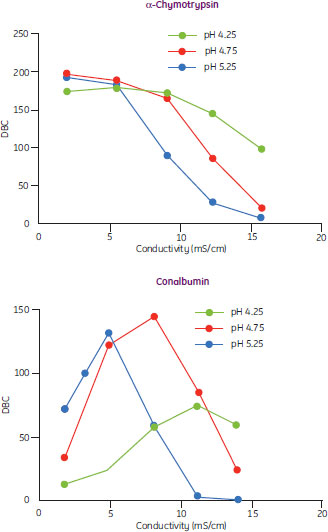
図7. 種々のpHにおけるα-キモトリプシンとコンアルブミンのDBC/電気伝導度曲線
α-キモトリプシンは電気伝導度の上昇に伴いDBCが低下する従来型の挙動を示し、コンアルブミンでは電気伝導度を上げていくとDBCが最大になるピークがあります。
スクリーニング法
電気伝導度を十分にスクリーニングすることの重要性について図8に示します。図8Aのように電気伝導度の低い1点だけしかテストを行わないと、結合容量が低いと結論付けてしまう可能性があります。電気伝導度の高い点をもう1点テストしても、従来型の挙動を示し、さらに容量が低いと結論付けてしまう可能性があります(図8B)。非従来型の挙動は、電気伝導度を十分にスクリーニングした場合(図8C)にのみ確認され、中間の電気伝導度において高容量が得られることになります。
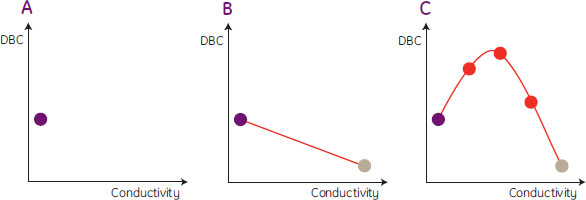
図8. 電気伝導度のスクリーニングが十分でない場合にDBCの最大値を見失ってしまう可能性を示した図
同様に、pHもDBCに影響するため、種々の電気伝導度に対してpHのスクリーニングも行う必要があります(図9)。pHが上昇するとタンパク質の電荷の総和が減少するため、最適な動的容量を得るためにはタンパク質の電荷の総和が小さいほど電気伝導度を低くする必要があります。動的結合容量の最大値がpHによって異なる可能性があることからも、電気伝導度とpHの双方のスクリーニングを行う必要性があります。
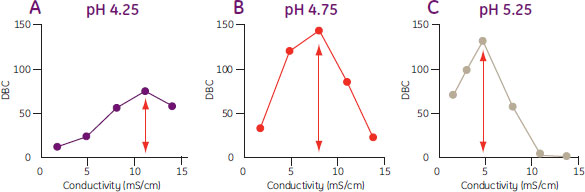
図9. 3種類の異なるpHにおけるコンアルブミンのDBC/電気伝導度曲線
DBCの最大値を異なる電気伝導度およびpHで測定。DBCの最大値はpHによっても変化。
逐次アプローチ
Capto™ Sの結合容量を評価する際には、迅速なスクリーニング法を用いることが適切です。逐次アプローチでは3~6回の実験により、目的タンパク質の挙動(従来型または非従来型)を明らかにし、DBCを推定することができます。逐次アプローチには次の3つのステップがあります。
- 目的タンパク質の等電点より1~2小さいpHを選択
- 3通りの電気伝導度(例えば3、6、9 mS/cm)についてDBCを測定
- pHを変えて電気伝導度を繰返しスクリーニング
最初のステップでは適切なpHを選択します。2番目のステップでは、3通りの電気伝導度についてDBCを決定しますが、その際まず低い電気伝導度から始め、電気伝導度変化の傾向が捉えられるよう十分狭い間隔で電気伝導度を上げていくようにします。上の例では3、6、9 mS/cmについて実験していますが、他の値でも構いません。3回の実験で得られたDBCを電気伝導度に対してプロットすると、様々なケース(図10)が起こり得ますが、これらは2つにグループ分けができます。図10Aのケースでは目的タンパク質は従来型の挙動(低い電気伝導度でDBCが最も高い)を示し、図10Bのケースでは目的タンパク質は非従来型の挙動(低い電気伝導度がDBCの最大ではない)を示しています。この3回の実験により、DBCの最大値を見出せる挙動のタイプが明らかになります。もしDBCが期待する値あるいは希望する値よりも小さい場合は、コンアルブミンの例(図9)のように別のpHについてもスクリーニングすることをお勧めします。
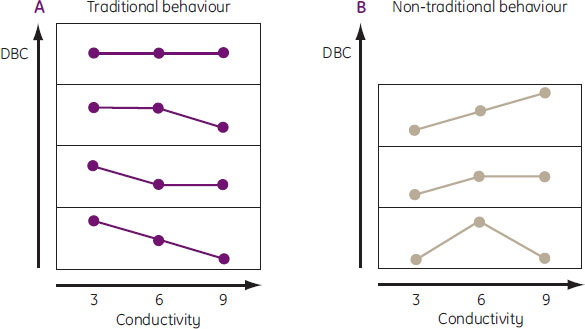
図10. 3種類の電気伝導度でDBCをスクリーニングする場合に起こる可能性がある種々のケース
A:タンパク質が従来型の挙動
タンパク質が非従来型の挙動
スクリーニングでの電気伝導度は、希釈または塩添加で調整しますが、希釈すると添加濃度も変化する点にご注意ください。添加濃度はそれ自体がDBCに影響する可能性があるため、実験結果は電気伝導度の影響のみでなく添加濃度の影響も反映してしまいます。また、用いる塩の種類も電気伝導度の最適値に影響を与える可能性があります。そのため、電気伝導度のスクリーニングの際には、添加濃度をできるだけ一定にし、異なる種類の塩を混合しないことが重要です。さらに、流速と温度を実験パラメーターとしない場合のスクリーニングには、適切な流速を用い、温度は一定に保ってください。
実験計画法によるアプローチ
実験計画法(DoE)の利用は、プロセスデザインにおける標準的ツールとなっています。このアプローチは逐次アプローチの代替法となるか、あるいは逐次アプローチによる実験を補完するものとなります。DoEでは計画した一連の実験ですべての関連要因を同時に変化させ、その結果の解釈は、予測、スクリーニング、最適化、頑強性評価に応用できる数学モデルを用いて行います。
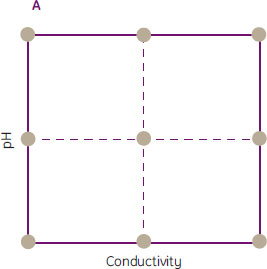
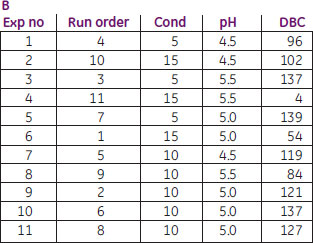
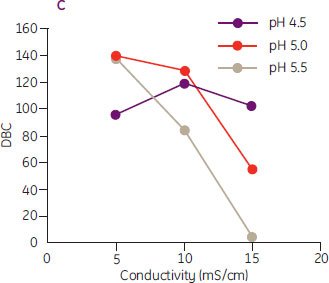
次の例では、Capto™ Sにおいて、モノクローナル抗体のDBCに及ぼすpHと電気伝導度の影響の評価にDoEがどのように利用できるかを示しています(参考文献2も参照)。MODDE™ 7プログラム(Umetrics社)を用いてpHと電気伝導度に関する面心複合計画を設定し(図11A)、3回の中心点測定を含む合計11通りの実験を行いました(図11B)。図11Cの生データプロットから、pHに依存して従来型(pH 5.0および5.5)と非従来型(pH 4.5)の挙動がみられることがわかります。電気伝導度は最低5 mS/cmまでしか実験していませんが、さらに低い電気伝導度について実験すれば、高いpH(pH 5.0および5.5)でも非従来型の挙動が観察されると考えられます。
クロスバリデーション(Q2=0.83)によれば、MODDE™によるデータ解析はモデルとして正しく(R2=0.98)安定性も良いものでした。係数プロット(図12A)ではpHと電気伝導度の双方が重要な要因であることが示されました。pHと電気伝導度の双方に曲率効果がみられ、またpHと電気伝導度の間の交互作用もみられました。よってこの係数プロットから次のことがわかりました。
- 電気伝導度(Cond)が高くなるとDBCは曲率を持ちながら低下(Cond×Condの依存性)
- pHが高くなるとDBCは曲率を持ちながら低下(pH×pHの依存性)
- 電気伝導度の効果はpHに応じて変化(Cond×pHの依存性)
- 高いpH(目的タンパク質の電荷の総和が小さい)では従来型の挙動
- 低いpH(目的タンパク質の電荷の総和が大きい)では非従来型の挙動
係数プロットの結果を図式化した応答局面プロット(図12B)から、電気伝導度が低く、かつpH 5.25付近の場合、DBCが最大値をとると予測できます。
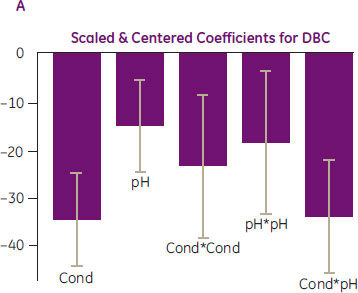
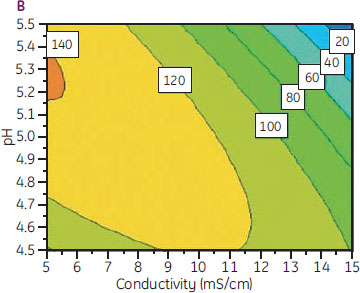
図12. (A)応答に有意に影響する項についての係数プロット、(B)pHと電気伝導度に応じたDBC予測値を示した応答局面プロット
非従来型の挙動が現れる理由
電気伝導度が低い場合
一定のpHで電気伝導度が低い場合、DBCの低下は、イオン交換体粒子内部へのマストランスファーが遅いことが原因です。マストランスファーが遅くなる理由は、次のような効果によるものと考えられます。
- 立体障害
- 微細孔の入口に強固に結合したタンパク質分子が、次に微細孔に入ろうとするタンパク質分子を微細孔に接近しにくくしている可能性あり。この効果は大きなタンパク質ほど顕著。
- 電気伝導度が高い場合に比べてdextran surface extenderの柔軟性が低下し、結合に使える微細孔容積が減少。
- 電荷反発
- 微細孔の入口に強固に結合した正に荷電したタンパク質が、次に微細孔へ接近してくるタンパク質分子に対して正電荷を提示する可能性あり。これが局所的な電荷反転となり、結果的に微細孔ネットワーク中へのタンパク質の流れを抑制する静電反発力となる可能性がある。電気伝導度が低い場合には、タンパク質分子周囲の電気的二重層が厚くなるため、この効果はより顕著。
これらの効果の結果、図13に示すようにビーズ表面近傍領域のみにタンパク質が吸着し、イオン交換体の粒子内部へのマストランスファーが極めて遅くなります。
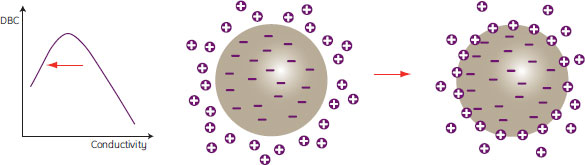
図13. 電気伝導度が低い場合の結合
マストランスファーが遅いため、処理時間を長くしてもタンパク質吸着は粒子表面でしか起こらない。
最適な電気伝導度の場合
電気伝導度が上がると、平衡容量は減少する一方で、マストランスファーは速くなります。電気伝導度が最適な場合は、平衡容量の減少よりもマストランスファーの向上の方がDBCに対して強い影響を及ぼします(図14)。
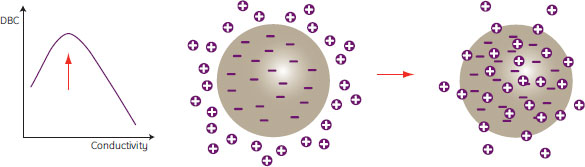
図14. 電気伝導度が最適値の場合の結合
タンパク質が微細孔中へ速やかに移動するため、DBCが高くなる。処理時間は図13の場合と同じ。
電気伝導度が高いと平衡は非結合状態の方へシフトし、タンパク質分子が微細孔中へ速やかに移動できるようになります。その結果、立体排除効果および電荷反発効果は全体として弱まります。さらに、溶液のイオン強度上昇に伴いデキストラン鎖の可動性が高まります。これらの効果は全て、微細孔ネットワーク全体にわたる非結合分子の移動を速めることにつながり、その結果、図14に示すように利用可能な全ての結合部位が速やかに飽和します。全体として、粒子当たりの結合タンパク質の量は、電気伝導度が低い場合よりも多くなります(最適なDBC値)。
電気伝導度が高い場合
電気伝導度が高い場合には平衡容量の減少の影響が優位になります。マストランスファーは速やかですが、得られるDBCのレベルは利用できる総容量に支配されてしまいます(図15)。電気伝導度が上がると「素通りモード」に近づいていきます。
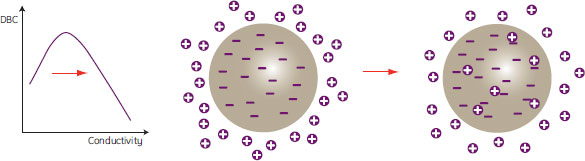
図15. 電気伝導度が高い場合の結合
電気伝導度が高いと平衡容量が減少するため、担体へのタンパク質結合が低下。処理時間は図13の場合と同じ。
pH依存性
上記の効果の静電気的な性質と、タンパク質の電荷の総和がpHに依存することを考慮すれば、溶液のpHがDBCおよびDBCが最大値となる最適な電気伝導度に対して大きな影響を及ぼし得ることは明らかです。pHが低い(タンパク質の正電荷が強い)場合、相互作用の程度やタンパク質同士の反発などのタンパク質の荷電に関係した効果はより顕著になり、ある一定の静電気的プロセスを起こすのに必要な溶液のイオン強度は、より高くなります。そのためにpHが低い場合にはpHが高い場合と比べて、最適な電気伝導度が高くなるのです。
まとめ
Capto™ Sは組換えタンパク質の初期精製および中間精製用、ならびにモノクローナル抗体精製の第2ステップ用の強陽イオン交換体です。この担体は、プロセスの経済性を改善するために、高結合容量およびハイスループットで操作できるように設計されています。この高結合容量と速やかなマストランスファー特性は、dextran surface extenderの利用およびHigh Flow Agaroseベースマトリックスの剛性により実現しました。
目的のタンパク質の示す挙動が従来型か非従来型かを予測することは難しいことから、Capto™ Sの添加条件をスクリーニングおよび最適化する際には、pHと電気伝導度の双方について調べることが重要です。Capto™ Sの性能を十分に引き出すためのスクリーニングには種々のアプローチが提唱されています。逐次アプローチは、少ない実験回数で従来型挙動か非従来型挙動かを判別し、最大の結合容量を得るための電気伝導度とpHを明らかにします。DoEによるアプローチでは同様の情報がより詳細に得られます。DoEを用いれば多くの要因や応答の追跡がより容易に行え、逐次的アプローチでは確認が困難な交互作用や二次項を明らかにすることができます。
参考文献
- Application note 28-4078-15: High-productivity capture of α-chymotrypsin on Capto™ S cation exchanger.
- Application note 28-4078-17: Capto™ S cation exchanger for post-Protein A purification of monoclonal antibodies.