第1章
タンパク質サンプル調製の概要(2)
ワークフローのデザインに関する考慮事項と一般的問題
適切なタンパク質分析ワークフローをデザインするための第1原則は、常に全体を見渡して、できる限り多くの正確な背景情報を収集することです。参考文献1および2もご参照ください。どの手法でもタンパク質がある程度失われることからサンプル溶液に対する操作は最小限にすることをおすすめします。
- 実験または研究全体の目的または目標を明確に規定します。
- その目的で使用できる複数の分析ストラテジーについて検討します。
- 網羅的なタンパク質分析が必要か、または既存の知識や仮説に基づいて分析対象となるタンパク質集団の範囲を狭められるか。
- 別のサンプル供給源が使用できるか。
- 別の分析手法または操作が使用できるか。
分析の目的が、細胞プロテオームの一部にのみ焦点を当てるかどうか検討します。一部のみであれば細胞分画手法を用いて複雑性が低い、特定グループのみのサンプルにします
。
標的となる可能性のあるタンパク質について文献などの情報があるか調べます。標的を絞った分析手法(Targeted LC-MS/MS、ウエスタンブロッティングまたは酵素結合免疫測定法[ELISA]など)は複雑度合やダイナミックレンジの影響を少なくでき感度が高い手法です。そのため、サンプル調製の操作が少なく済みます。
- 目的タンパク質を含むサンプル供給源について情報を集めます。
- タンパク質の種類とダイナミックレンジ
- 構成するタンパク質のおよその濃度
- サンプル供給源は、目的タンパク質集団のダイナミクスを十分反映しているか
- 夾雑物の種類と存在量
- タンパク質の分画局在化、抽出の難易度
- 有害な酵素活性のレベルと種類
- 目的タンパク質の分析手法について情報を集めます。その分析手法では、全体的な検出度合を示す基準として何が使用されているかを確認します。
- 総タンパク質添加量の範囲
- 容量の範囲
- 各タンパク質の検出限界
- ダイナミックレンジ
- 複雑性に対する許容性(分離能とほぼ同義)
- 夾雑物に対する許容性
- 生物学的な構造と活性を保持する必要性
夾雑物を、許容できるレベルにまで低減することを目指してください。ただし、過剰な除去は行わないでください。
- その他の考慮事項
- 同時に処理するサンプルの数(例:平行処理。)
- 各供給源から入手できる初期サンプル量
- 使用できる資源
- 許容できる費用
- 各ステップの論理的順序または一定のステップの調節
ワークフローの全体像を念頭に置いて、調節が必要となるステップを最小限に抑えるようにします。例として、タンパク質の一級アミンに標識する場合はトリスバッファーの使用を避ける、分画に使用するクロマトグラフィー手法の適切な順序を選択する(例:IEXの次にRPCを行う)などが挙げられます。ワークフローにおいてステップ数を少なくするだけで、全体的な性能を高めることができます。
- 現在ある情報に基づいて、各分析ストラテジー(サンプル供給源の組合せ、目的タンパク質集団および分析手法)に関連する課題をリストアップしランク付けします。最適な検出度合、収量および再現性には複雑な負の相関関係があり、これについても考慮が必要です。実験計画はできる限り単純にするのが一般的です。
- リストアップした課題に対処し、成功の可能性を評価するためのサンプル調製計画を大まかに作成します。
- もっとも有望な方法を選択した後、サンプル調製の操作数と種類を詳細に計画し、操作を最適化します。
タンパク質の検出度合の改善を目的としたタンパク質除去、分画およびアフィニティー濃縮の一般的な組合せ
これらの手法の詳細については第3章で詳述予定です。
生体液の網羅的分析では、もっとも存在量が多いタンパク質を除去した後に、大規模な分画(> 50画分)を行います。この方法で、血漿中にもっとも多く含まれるタンパク質を最大20種類除去できます。プロテオームを構成するより多くのタンパク質を分析するにはさらに分画が必要です。タンパク質除去済み溶液中のタンパク質濃度が低いと、さらに多くの血漿が必要となり、後の分析が困難になる場合もあります。また、高存在量タンパク質の中には目的タンパク質と結合することがあり、除去過程で目的タンパク質も一緒に除去される懸念もあります。したがって、温和な条件で除去する、素通り画分や結合画分は分析に供しないなどを検討するとよい良いでしょう。
非変性条件を用いたタンパク質グループの標的分析では、アフィニティー濃縮を単独で使用するか、その後に中程度の分画を行います。高品質の特異的結合物質を入手することが必要となります。
変性条件を用いた分析では、中程度から大規模な連続して行える分離法を組み合わせて分画を行います。一般的なストラテジーとしては、IEXを行った後、各段階画分についてRPCを行います。
タンパク質レベルでの分画は、所定のワークフローで行うことができる分析の深さを掘り下げる強力な手段であるものの、以下のような課題もあります。
- 低存在量タンパク質を得るために十分な量のサンプルが得られない場合があります。
- 分画手法の数と複雑さが増えるのに伴い、全体的な収量が減少し目的タンパク質の損失リスクが増大します。
- 時間とコストの制約が存在します。大規模な分画を行い、その各画分を分析するとなると、そのワークフローのスループットに重大な影響を及ぼし、初期サンプル当りのコストが劇的に増大します。
一般に網羅的分析では全タンパク質の分析を可能にするために出発段階から大規模な分画を行う必要があります。できる限り細胞分画やタンパク質サブグループの濃縮といった標的を絞った手法を使用することをおすすめします。網羅的分析が最終的な目標であっても、網羅的方法を直接使用するのではなく、サブプロテオームレベルの複数の試験で得られた結果を組み合わせるほうが効率的で実現可能性が高いことがあります。分画が最適である場合には、分画のステップ数と分析するサブサンプルの数を最小限に抑えながら分析の目標を達成できるようにデザインすることをおすすめします。
ワークフローの実例
ワークフローのデザインの考慮事項について述べてきましたが、次よりワークフローの実例をご紹介します。
背景
細胞シグナル伝達など細胞の基本的機能は、一般にタンパク質中のチロシン残基のリン酸化(pTyr)により調節されます (11)。チロシン残基の調節異常はガンに大きく関与することが多いため、リン酸化されるタンパク質の研究は大きな注目を集めています。基本的な目的は、網羅的MS手法を用いてチロシンリン酸化を受けるタンパク質を特定してpTyr基質マップを作成することです。このようにチロシンリン酸化タンパク質を仮説フリーかつ網羅的に探索することが、以下で概説するワークフローの目的です。このワークフローは、細部を調節することで個々のチロシンリン酸化に関するより詳細な研究(ディファレンス解析など)にも使用できます。
主な課題として、細胞シグナル伝達タンパク質の大半は、細胞内タンパク質の中でコピー数が少ないことがあげられます。一般に網羅的MS手法では直接検出ができません。もう1つの課題として、MSの通常の分析条件ではリン酸化ペプチドのイオン化効率が低いため、MSの感度が低下します。また、pTyrタンパク質は他の種類のリン酸化タンパク質に比べて少量です。ヒトではアミノ酸残基のリン酸化全体の約10%をスレオニンのリン酸化、90%をセリンのリン酸化が占め、チロシンのリン酸化はおよそ0.1%に過ぎません (11)。さらに、in vivoでは、キナーゼとホスファターゼがともに高活性状態にあることが、リン酸化のレベルを決定する要因になることが多いと考えられます。サンプル調製がうまくデザインされていないと、in vivoにおける微妙な酵素活性バランスが脱リン酸化側にシフトするため(キナーゼの活性はATPに依存し、ATPはin vivo条件下でのみ生成されます)、最初の数ステップでバイアスがかかります。
ワークフローの説明
このワークフローは、MS分析の前にpTyrタンパク質の大規模濃縮が必要不可欠であることを前提に構築しています。高品質のpTyrエピトープ特異的抗体が入手できたことから、高度に特異的アフィニティーをベースとした濃縮をデザインしました。以下のように、ワークフロー全体を念頭に置いて各ステップのデザインを行うことで、操作の数を最小限に抑えました。磁気ビーズフォーマットを使用し、濃縮と濃度調節を1つのステップにまとめ、溶出バッファーをシンプルにデザインし、ペプチドの濃度調節と脱塩を一連の操作で行い、そのまま分析分離に進むデザインとしました。初期サンプルを大量に得てそこから濃縮を行えるように、またオプションとしてチロシンホスファターゼのin vivo抑制を行えるように、富栄養培養したチャイニーズハムスター卵巣(CHO)細胞をサンプル供給源として選択しました。サンプル採取の2時間前に培地に不可逆的チロシンホスファターゼ阻害剤である過バナジン酸を添加することで、pTyrタンパク質の数を最大化できました。過バナジン酸はタンパク質組成の他の変化(酸化ストレス反応など)も誘発することが知られていますが、このようなアーチファクトは実験の目的を妨げないと考えました。阻害の影響を評価するために、in vivo過バナジン酸処理を行わないコントロール実験も行いました。このワークフロー全体を図1.2に示します。
その結果、pTyr タンパク質と推定される計76種類のタンパク質が特定されました(図1.3、表1.2)。そのうち54のタンパク質は過バナジン酸処理した細胞のみに見られ、コントロール細胞および出発物質には含まれていませんでした。これらのタンパク質の一部、例えばCaveolin-1や局所接着キナーゼ(FAK)は、接着経路に関与することが知られています。このようなタンパク質はアクチン細胞骨格の調節に関与するといわれています。細胞運動性または細胞生存に関与する他のタンパク質も検出されました。コントロールサンプル(非処理細胞)から検出されたタンパク質は22種類のみで、主として高存在量の酵素とリボソームタンパク質で構成されていました。このことから、酵素制御が重要であることが明らかに示されます。
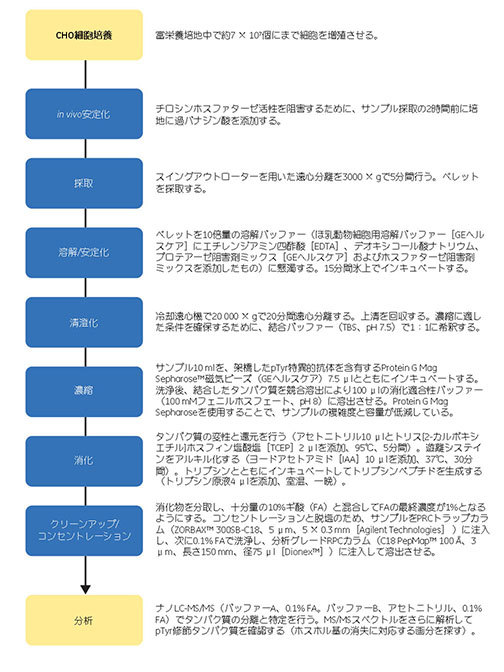
図1.2 MSを用いたCHO細胞中のpTyrタンパク質のマッピングに関するワークフローの概要
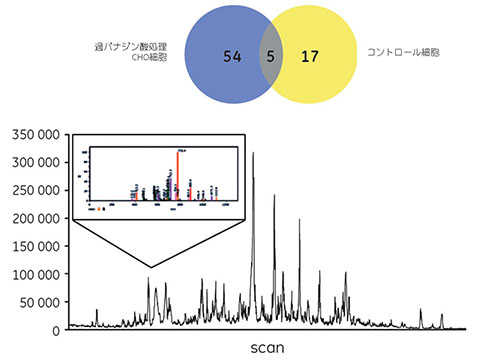
図1.3 過バナジン酸処理細胞とコントロール細胞で特定されたpTyrタンパク質の数。ナノLC-MS/MS分析で得られたベースイオンクロマトグラムとともに、あるpTyrペプチドのMS/MSスペクトル例を示します。このペプチドはPTPn11と同定されました。
表1.2 過バナジン酸処理CHO細胞でのみ特定されたヒット数上位20のpTyrタンパク質
| Protein |
Total |
Mr |
Accession number |
| protein tyrosine phosphatase |
22 |
68.3 |
gi|458333| |
| caveolin-1 |
11 |
20.5 |
gi|603661| |
| beta-tubulin isotype I [Cricetulus griseus] |
6 |
49.6 |
gi|473884| |
| Cav1 protein [Rattus norvegicus] |
1 |
19.7 |
(H) gi|124504347| |
| AHNAK [Mus musculus] |
6 |
224.0 |
gi|37675525| |
| focal adhesion kinase |
8 |
119.1 |
gi|193224| |
| beta tubulin [Cricetulus griseus] |
1 |
49.7 |
(H) gi|537407| |
| gamma-actin |
1 |
41.8 |
(H) gi|309089| |
| M1 pyruvate kinase [Rattus norvegicus] |
5 |
57.8 |
gi|206204| |
| cortactin |
5 |
61.2 |
gi|509495| |
| 47-kDa heat shock protein [Mus musculus] |
4 |
46.5 |
gi|303678| |
| ABL2 [Mus musculus] |
3 |
128.1 |
gi|68139002| |
| sorting nexin associated Golgi protein-1 (SNAG1) [Mus musculus] |
4 |
67.9 |
gi|15559064| |
| polymerase I-transcript release factor (PTRF) [Mus musculus] |
3 |
43.9 |
gi|2674195| |
| calmodulin synthesis |
3 |
16.8 |
gi|192365| |
| beta-actin [Marmota monax] |
1 |
32.0 |
(H) gi|9864780| |
| unnamed protein product [Rattus norvegicus], enolase 1 |
3 |
47.1 |
gi|56107| |
| eps8 binding protein [Rattus norvegicus] |
3 |
51.7 |
gi|5882255| |
| Chain B, Refined 1.8 Angstr oms Resolution Crystal Structure Of Porcine Epsilon-Trypsin |
3 |
8.8 |
gi|999627| |
| Rous sarcoma oncogene [Mus musculus] |
3 |
59.9 |
gi|123219085| |
タンパク質サンプル調製ハンドブック目次 |1章 References | 略号と用語、記号解説



