第3章
目的タンパク質の検出性改善(7)
アフィニティーベースのタンパク質濃縮およびタンパク質サブグループの濃縮(3)
ヒト血漿からのプラスミノーゲンの濃縮
Streptavidin HP SpinTrap™と、ビオチン化mAbを使用して、ヒトの血漿からプラスミノーゲンを濃縮しました。全タンパク質の濃度は約50 mg/ml、プラスミノーゲンの濃度は0.2~0.3 mg/mlで、これは全タンパク質濃度の約0.5%に相当します。図3.8に、Streptavidin HP SpinTrap™を使用して濃縮したプラスミノーゲンのSDS-PAGEの結果を示します。
使用した製品:Streptavidin HP SpinTrap™
サンプル:ヒト血漿
サンプル容量:20 μlおよび100 μl
抗体:モノクローナルマウス抗プラスミノーゲン(ビオチン化)
結合バッファー:TBS(50 mMトリス、150 mM NaCl、pH 7.5)
洗浄バッファー:TBS、2 M尿素、pH 7.5
溶出バッファー:0.1 M塩酸グリシン、2 M尿素、pH 3.0
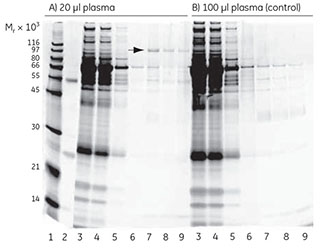
レーン
- タンパク質分子量標準物質(およその範囲)
- 抗体
- 素通り画分(1:30に希釈)
- 1回目の洗浄画分(1:10に希釈)
- 3回目の洗浄画分
- 5回目の洗浄画分
- 1回目の溶出画分
- 2回目の溶出画分
- 3回目の溶出画分
図3.8 ヒトの血漿からのプラスミノーゲンの濃縮。(A)SDS-PAGEによる分析。ゲルはDeep Purple Total Protein Stainで後染色し、Ettan™ DIGE Imager(販売を終了しております。Typhoon™ FLA 7000およびTyphoon™ FLA 9500にて同様の解析を行うことができます)でスキャンしました。矢印は、MS分析で特定されたプラスミノーゲン(Mr 93 000)の位置を示します。(B)ステップ2を省略。コントロールサンプルは血漿サンプルと同じ方法ですが、抗体を結合させずに泳動しました。
共有結合リガンドを用いたタンパク質の濃縮
NHS Mag Sepharose™やNHS HP Spin TrapのようなNHS-activated担体は、一級アミノ基を含むリガンドの化学的結合に適しています。例えば、リジン側鎖やブロックされていないN末端のα-アミンを介するタンパク質の結合です。リジンのε-アミンを介するタンパク質の結合は、新しく調製したバッファー(0.2 M NaHCO3、0.5 M NaCl、pH 8.3)の中で行います。これで安定なアミド結合が得られます。
この反応はNHSエステルをめぐって加水分解反応と競合します。pHが高く、タンパク質溶液または生体分子溶液の希釈率が高いと加水分解がより速く生じます。一級アミンを含む他の分子を除去するため、脱塩またはバッファー交換ステップなどを行う必要があります(第4章を参照してください)。
NHSエステルと適合するバッファーを表3.4に示します。
表3.4 NHSエステルと適合するバッファー
| Buffer |
pKa (20°C) |
Buffer |
pKa (20°C) |
| Acetate |
4.75 |
MOPS |
7.20 |
| Succinate |
5.57 |
HEPES |
7.55 |
| MES |
6.15 |
Phosphate |
7.21 (pKa 2) |
| Carbonate |
6.36 |
Triethanolamine |
7.80 |
| Citrate |
6.39 |
Bicine |
8.35 |
| PIPES |
6.80 |
Borate |
9.24 |
| Imidazole |
6.95 |
|
|
>>目的タンパク質の検出性改善(8)
タンパク質サンプル調製ハンドブック目次 |3章 References | 略号と用語、記号解説


