Sensor Chip CM5に特定のタンパク質をAmine coupling法にて固定化する。非常に一般的な方法の一つです。一方でアミンカップリング法による固定化がうまく行かない、というお問合せも良く頂きます。今回はアミンカップリングのあれこれについて解説いたします。
Amine Coupling Kitについて
弊社から販売しておりますAmine Coupling Kitは以下の2種類です。
Table 1
| 製品名 | コード番号 | コンポーネント | 備考 |
|---|---|---|---|
| Amine Coupling Kit | BR100050 |
| Biacore™ 4000、A100、S51 を除く全ての Biacore™ システム |
| Amine Coupling Kit, type2 | BR100633 |
| Biacore™ 4000、A100、S51 専用 |
Table 1に示すように、type2はEthanolamineの瓶が2本分になっており、これはEthanolamineを多く消費するBiacore 4000, A100, S51 専用のキットとなっております。
Figure 1
使用方法
Ethanolamineに関してはready-to-useですが、EDCとNHSに関しては粉末で初めに10 mLの超純水で溶解する必要があります。EDCやNHSが封入されたガラス瓶それぞれに10 mLの超純水を加えた後、蓋を固く締め、完全に粉末が溶解するまで強く撹拌します。その後、バイアルなどに適切な量で分注し、-18℃以下で冷凍保存します。冷凍保存の際は一度に使用する量ずつ、普段ご利用のバイアルなどに分注しておくと便利です(Figure 2)。
必要量はControl softwareを起動し、それよりも少し多めに用意するようにしてください。

Figure 2
EDC, NHSの使用上の注意
EDC、NHSは粉末の状態でおよそ1年(納入された時期にも依りますのでキットのExpiry dateを必ずご確認ください)、超純水に溶解してしまった時点で冷凍保存していたとしても2か月程度経過すると徐々に活性が低下していきます。高分子同士の測定などで比較的固定化量が少ない実験系を行う場合は2か月以上経過した試薬を利用してもさほど問題にはならないはずですが、低分子の測定を行う方でリガンドの固定化量を最大にして測定する場合には問題になり得ます。そうした場合は新しいAmine Coupling Kitのご購入をお願いいたします。
プレコンセントレーション効果について
アミンカップリング法で用いるSensor Chip は最も代表的な CM5 をご利用いただくことが多いです。 Sensor Chip CM5 は金膜にカルボキシメチルデキストランが固定化されており、pH 3.5以上ならば電離しているため Sensor Chip CM5の表面は負に荷電しています。ここで、リガンドが貴重で低いリガンド濃度でもアミンカップリングを効率的に実施したい場合は、リガンドとなる分子を正に荷電させることで Sensor Chip 上に静電的な濃縮効果を起こし(=プレコンセントレーション効果)効率よくアミンカップリングを実施することができます。リガンド自身の等電点(pI)よりも0.5以上低いpHかつイオン強度も低い(≒塩濃度も低い)緩衝液でリガンドを希釈することで、リガンドを正に荷電させることができます(Figure 3)。弊社ではそれに合わせてpH5.5から4.0までの0.5刻みでAcetate bufferを販売しております。
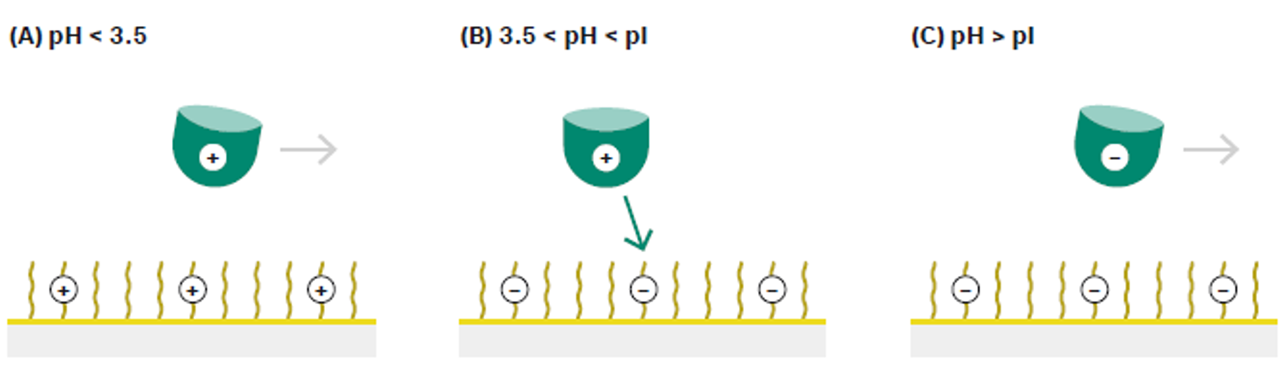
Figure 3
これにより、以下のようにEDC・NHSで活性エステルが作られ、続くリガンドの添加でリガンド分子を共有結合により固定化することができるわけです(Figure 4)。
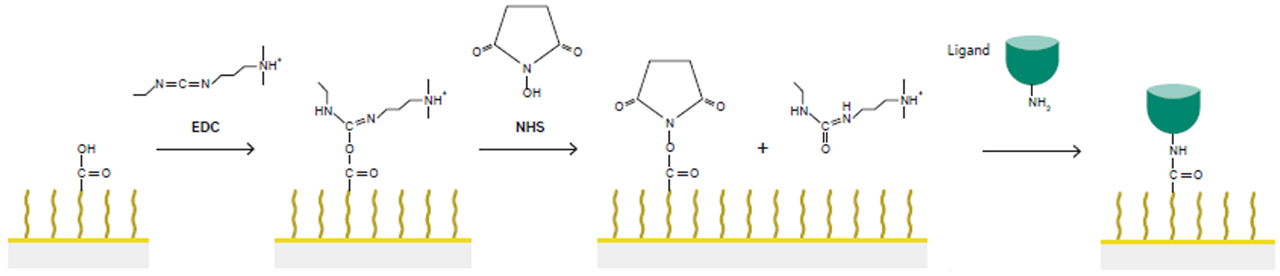
Figure 4
アミンカップリングがうまく行かない?センサーグラム形状からうまく行かない原因を予測する
さてここからが本題です。以下、使用している試薬・消耗品類は正しく保管された期限内のものを使用しているとしてお伝えしてまいります。 Figure 5Aは典型的なアミンカップリング法での固定化のセンサーグラムです。
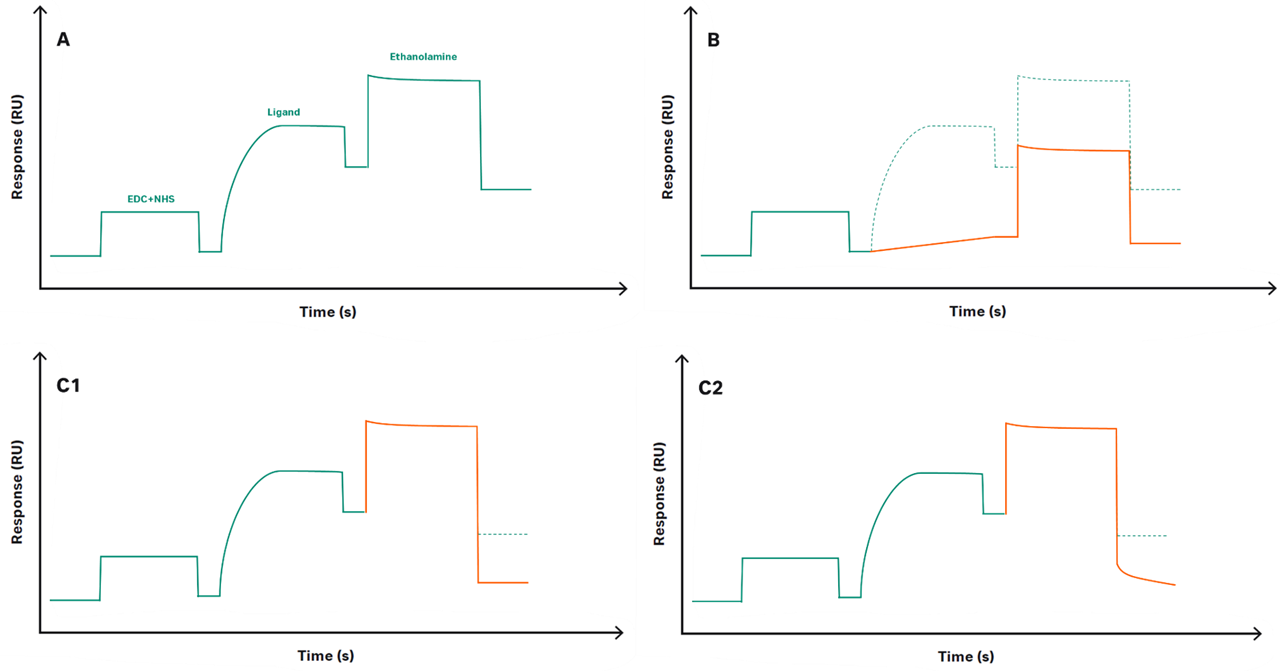
Figure 5
Figure 5B(プレコンセントレーション効果の傾きが妙に弱い)
- リガンドの濃度が低い
目標のリガンド密度にも依りますが、<50ug/mL程度の範囲で高濃度で固定化する必要があります。 - リガンドストック溶液をAcetate bufferで希釈する際の希釈倍率が低すぎる
十分なプレコンセントレーション効果を起こすためには少なくとも10倍程度以上には希釈できていた方が良いです。10倍という数字はあくまで目安です。 - リガンドストック溶液中に高濃度の塩が含まれている
塩は静電的効果を抑制してしまいます。これも10倍程度以上の希釈倍率の確保と関係しています。 - Acetate bufferのpHが高い
0.5低いpHのAcetate bufferをお試しください。ただし下限はpH4.0です。pH3.5ではカルボキシメチルデキストラン上のカルボキシ基が電離しなくなります。
Figure 5C1, 5C2(Ethanolamine添加後に大幅にレスポンスが低下する、顕著な場合は添加後に下向きのドリフトが見られる)
- リガンド濃度が高すぎる
リガンドが添加された後、非共有結合でチップ表面に残存しているリガンドは続くethanolamineの添加で洗い流されます。まれにリガンドの物理的な性質で避けられない場合もあります。
またその他、リガンドを添加した後のethanolamineを添加する前のレスポンスが顕著に低いことがあります。このケースでは通常は活性エステルの数が少ない、すなわちEDCやNHSの劣化を疑いますが、まれにリジン残基が少ないサンプルである場合があります。
まとめ
いかがでしたでしょうか。非常に代表的な固定化方法のアミンカップリング法ですが、意外と気を付けなければならないところや考察できるところが多く、また一度固定化したらやり直しが効かないという点も問題となります(一度アミンカップリングした表面に対して再度アミンカップリングを実施すると、既に固定化されているリガンド自体も多点でアミンカップリングしてしまったり、固定化されたリガンド自体にもアミンカップリングされてしまうことで網目状構造を取り、アナライトが自由な運動ができなくなります)。
また今回は解説しておりませんが、直接固定化されたリガンドは剥がすことはできませんから、アナライト結合後の再生条件の検討も時間がかかるかもしれません。
こう考えていくとやはりキャプチャー法の方が多くの面で優秀です。ぜひ始めにキャプチャー法の利用ができるかどうか検討していただくことをお勧めいたします。