Q アミンカップリングでタンパク質をCM5チップに固定化したのですが固定化できているような気がしません。何が起きているのでしょうか?
A ①プレコンセントレーション効果が正しく得られていない、②変性している、③試薬が失活している、のいずれかであると思われます。多くの場合は③が原因です。
まず①のプレコンセントレーション効果が正しく得られていない、について解説いたします。キット製品の場合は、プレコンセントレーション効果が適切に得られる緩衝液が同梱されているためあまり問題になりませんが、ご自身で用意されたサンプルの場合によくあるトラブルです。
アミンカップリングは一番基礎的なリガンドの固定化方法のようですが意外と注意すべきところがあります。初めて固定化するタンパク質の場合、pH scoutingにてどのpHのAcetate bufferでプレコンセントレーション効果が見られるか確認することになります。
Figure 1ではそもそもプレコンセントレーション効果がほとんど見られていません。これではリガンドを固定化することはできません。恐らくリガンド表面が正に荷電していないことが原因なのですが、これはいくつかの要因が考えられます。Table 1にまとめました。
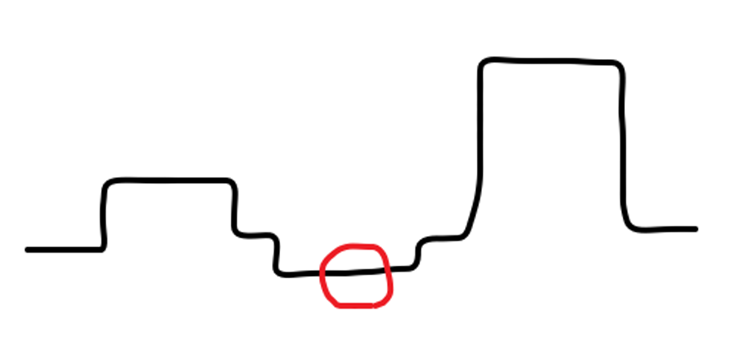
Figure 1:アミンカップリングの失敗例。赤丸部分がリガンド添加だが全く傾きが見られていません
主たる要因 |
うまく固定化できない理由 |
備考 |
|---|---|---|
| Acetateによる希釈率が低すぎる | 十分に酸性条件に曝せていないため。 | 数倍程度の希釈率ではプレコンセントレーション効果は得づらい。溶液交換すると良い。 |
| リガンドのストック溶液濃度が低過ぎる | 十分に酸性条件に曝せていないため。 | 終濃度数~数十ug/mL程度の濃度になるようストック溶液自体を溶液交換すると良い。 |
| 塩の持ち込みが多い | 塩により静電吸着が抑制されているため。 | ストック溶液自体に高濃度の塩が入っている場合は脱塩処理(溶液交換)すると良い。 |
Table1
続いて②の変性している、について解説いたします。Figure 2のpH4.0ではプレコンセントレーション効果は見られていますがリガンド添加終了後速やかにベースラインに戻っていません。これは既にリガンドが変性や凝集しているため、固定化したところでアナライトとの結合は見られない可能性が高く、それどころか変性したタンパク質に対する意図しない非特異的結合が出てしまうかもしれません。このようなセンサーグラムでは、固定化のメソッドを走らせる際のpHは4.0以外であれば何でも良いのですが、基本的にはできるだけマイルドなpH 5.5を用います。ただしpH 5.5の場合、3000RU程度でサチュレートしているため、固定化量の上限もそれくらいになるはずです。理論的Rmaxが20-50RU程度に収まるような固定化量かどうか判別し、足りないようであればpH 5.0や4.5を採用したり、5.5のまま添加時の濃度を高くする(最大で50 μM程度)などで対応します。これでも対応できないようでしたらアミンカップリングはそもそも向いていません。ビオチン標識してBiotin CAPture Kitを使うかSAチップを使う方が良いでしょう。
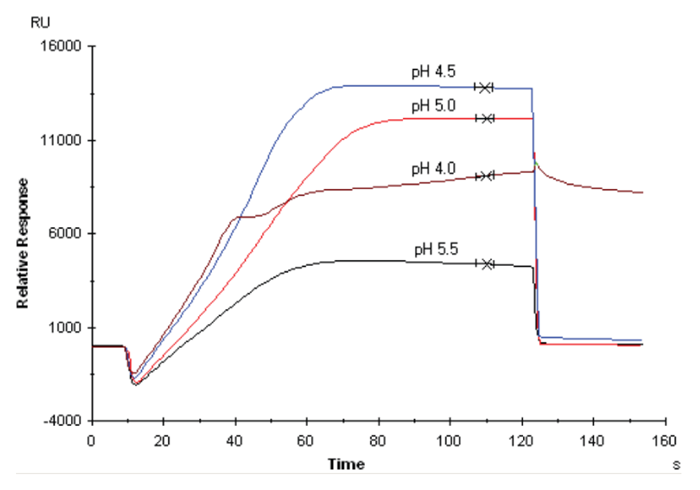
Figure 2
続いて③の試薬が失活している場合について解説します(多くの原因)。
EDC、NHSはガラス瓶に粉末の状態で納品されます。粉末の状態であれば比較的長期間安定して保存可能ですが、超純水で溶解した時点で冷凍保存しても2か月ほど経過すると徐々に活性が低下していきます。最大の固定化量が必要な測定の場合や、固定化量を厳密にコントロールしなければならない測定の場合は影響を受けることになります。
ガラス瓶から使用する量だけ秤量し、都度超純水で溶解する方法であれば事実上の保存期間が延長されますが、EDC、NHSの濃度が標準の濃度と異なって作成されてしまう可能性が高くなるため推奨できません。そもそも特にNHSは静電気でバイアルに吸着し正確な秤量が難しい他、EDCは瓶を開閉することで吸湿し、活性が低下してしまいます。

Figure 3:Biacore™ T200/S200の場合は7 mmバイアルに直接分注して冷凍保存すると便利です
ただし、2か月後にいきなり全く固定化できなくなるわけではありません。チップ表面上の活性エステルの数が徐々に少なくなっていくので、最大固定化量を目指す以外の実験ではそこまで大きな影響はないかもしれません。それでも徐々に固定化量は減っていくでしょうから、どこかで新たにキットをご購入いただく必要があります。