はじめに
Biacore™におけるフィッティング解析では、複雑なモデル式であるほど解析後のパラメータも信頼を担保するのが難しくなる傾向があります。
従って可能であれば、できるだけシンプルな1:1 binding modelで解析するのが望ましいと言えます。Bivalent analyte modelも複雑なモデル式の一つで、信頼できるパラメータを返すには繊細なアッセイセットアップが必要になります。
どういった結合様式に適用できるモデル式ですか?
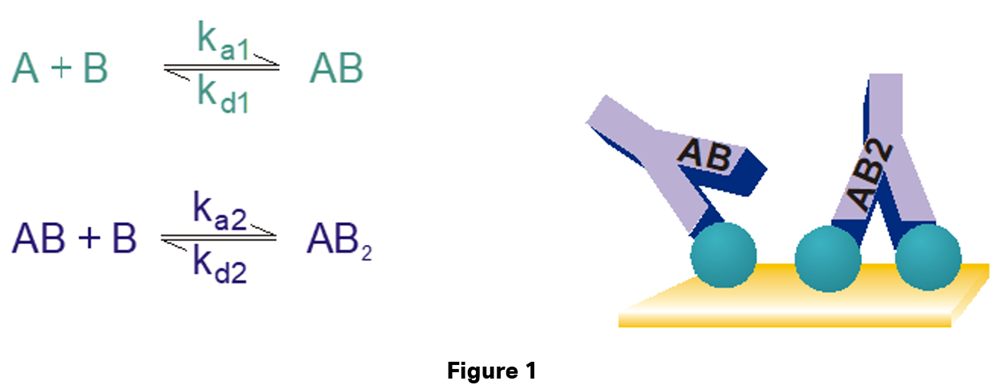
モデル式の名前の通り、アナライトが(同じ親和力を持つ)二価の時に利用するモデル式です。一番想定されるのは抗体をアナライトにした系となります(右図)。同じ抗体でも、Bispecific抗体のような、親和力が異なる分子の場合はBivalent analyte modelは適用できません。これ以外にもアナライトが二量体を取っているパターンでも使用することができます。
各パラメータはどういう意味があるのでしょうか?
各パラメータの単位は以下のようになります。ご覧の通りka1とka2の単位は異なり、単純に比較することはできません。
| パラメータ | 単位 |
|---|---|
| ka1 | M-1s-1 |
| kd1 | s-1 |
| ka2 | RU-1s-1 |
| kd2 | s-1 |
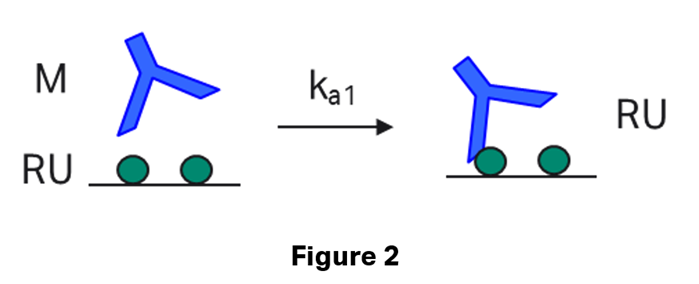
二価のアナライトの結合を評価するモデルでは、アナライト上の2つの独立した部位での相互作用を記述します。最初の部位で結合が起こると、表面で複合体が形成され、反応が進行します(Figure 2)。1:1 bindingの場合と同様に、フリーアナライトの濃度はMolar単位であるのに対し、リガンドと複合体の濃度はRU単位となります*。この結果、この第1サイトの結合速度定数はM-1s-1となります。
*複合体の量はBiacore™で観測されるレスポンスR(RU)と比例します。Rmax – R はフリーのリガンドの量と比例します。
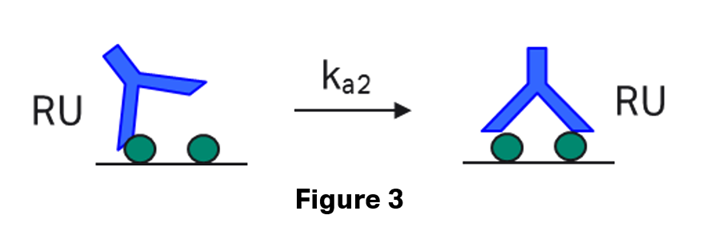
しかし、第2サイトでの結合が起こる時は、アナライトは既に第1サイトを通じて表面に付着しており、反応物は第1サイトが結合した複合体とフリーリガンドであり、両方とも表面上にあります。そしていずれの濃度もRU単位になります。したがってこの第2の相互作用の結合速度定数はM-1s-1ではなく、RU-1s-1で得られます。
第2サイトの相互作用の挙動は理想的には抗体は基本的には対称性をもつので同等であることが期待されますが、立体障害などの問題もあるかもしれませんし、そもそもセンサーチップ上という特異な環境で起こる現象であり、適切なモデル式で記述できているかについてやや疑問があります。その結果例えば、ka2の場合算出されるRU-1s-1単位での解が意味のある数値と考えづらいため、ka2、kd2、KD2を利用することはありません。
詳細なモデル式はどうなりますか?
以下のようになります。

KD値を求める際の留意点
ソフトウェア上KD値が自動算出されませんが、教科書的にはKD=kd1/ka1で算出する手順となります。
しかしながらここまで述べてきたように、第2サイトのセンサーチップ上で実際に起こっている相互作用の挙動を記述すべき、モデル式(ka2、kd2を含む項)の信頼性が低いのがBivalent analyte modelで気を付けなければならないことです。したがって、得られるレスポンスはできるだけ第1サイトの相互作用が支配的な条件にして測定・解析した上で、得られた数値の再現性や頑健性を1:1 bindingの相互作用の場合より多く行い、ご研究のデータとして採用するかどうかのご判断を慎重にすることをお勧めします。
アッセイセットアップで注意すべき点はありますか?
前提
リガンド密度の高低、アナライト濃度の高低で色々と状況が変わります。まずリガンド密度について見ていきます。
リガンド密度が高い場合はアナライトは第1サイトが結合した後、第2サイトも別のリガンドを容易に見つけることができます。その結果、複合体は安定化し、どちらかの結合サイトで解離が起きても、もう片方のサイトでアナライトは表面に保持されます。リガンド密度が低い場合はアナライトが2つのリガンド分子に同時に到達できる可能性は低くなり、結合はより1:1 bindingに近いものとなります*。
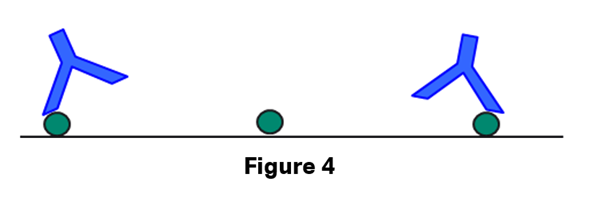
*実際、表面のリガンド量を極限まで減らしてアナライト(150kDaの抗体とします)のRmaxが数RUになるようにすれば、この状況を実現することが実験的に可能です。
一方でアナライト濃度が高い場合は第1サイトだけで結合する分子が増えることになります(Figure 5,6)。
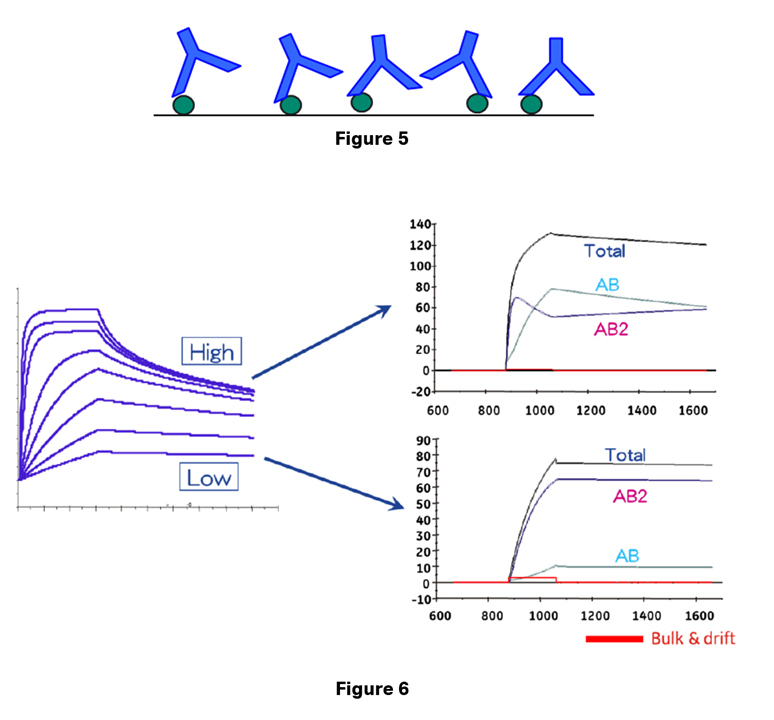
アッセイセットアップ
上述の通り、(1)リガンドの密度と(2)アナライトの濃度について注意する必要があります。
(1)リガンドの密度
以下では抗原抗体反応を例に解説していきます。Figure 7ではリガンド(抗原)はセンサーチップ上に直接固定の系をお示ししておりますが、キャプチャー法を取っても構いません。その際はアナライトの抗体がキャプチャー分子と交差反応を示さないことを確認しておいてください。
上述の「前提」でお伝えした通り、リガンドの量が多いと架橋したアナライトが増えてしまいます。Bivalent Analyte modelでは第1サイトだけで結合していた分子が解離する様子と、第1・2サイトで架橋していたアナライトがゆっくりと解離していく様子の二相性*が見える必要があります。
この結合様式の場合、立体障害や親和力の問題で全ての抗体が第1サイトだけでリガンドと結合することは現実的には起こり得ず、そのため本来は理論的Rmaxが規定できません。指標として全て二元複合体を形成しているときを想定して(=全ての抗体が第1サイトだけで結合していると仮定して)理論的Rmaxを考え、ひとまずそれが1:1 binding modelのKinetics解析の理論的Rmaxの推奨範囲と同等の、20-50 RU程度得られていれば良いでしょう。二相性が見えづらいようならもっとリガンド量を減らしてください。
* 第1サイトの親和力が非常に強い場合、Figure 7のようにきれいな二相性が見えないこともあります。
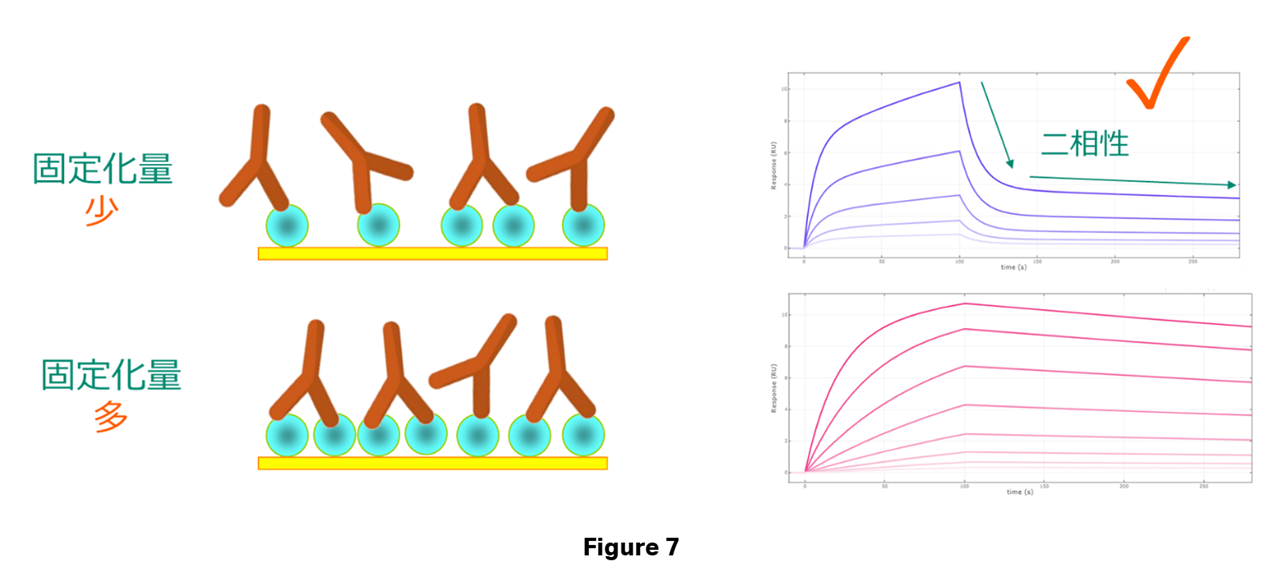
(2)アナライトの濃度
高濃度から低濃度まで幅広く条件を振っていただくことをお勧めいたします。Figure 7でお示しした通り、高濃度では第1サイトのみで結合するアナライトが増え、低濃度では第2サイトも結合し架橋したアナライトが増えます。こちらも同様にどれくらいの濃度で測定すればよいか指定できず、普段の1:1 binding modelで測定する時よりも広い濃度帯で、測定濃度条件も増やし、二相性が見えるかどうかで濃度を調節してください。