キャリーオーバーとは?
いくつかの低分子化合物は “sticky” であり、センサーチップ表面やフローシステムから洗い流すのが困難なことがあります。こういった残留物が次のサイクルに影響を及ぼす(キャリーオーバー)ことがあります。
キャリーオーバーの検出方法
carry-over injectionを使用します。新製品のBiacore™ 1 seriesの画面を見てみましょう(その他のBiacore™システムでも同様です)
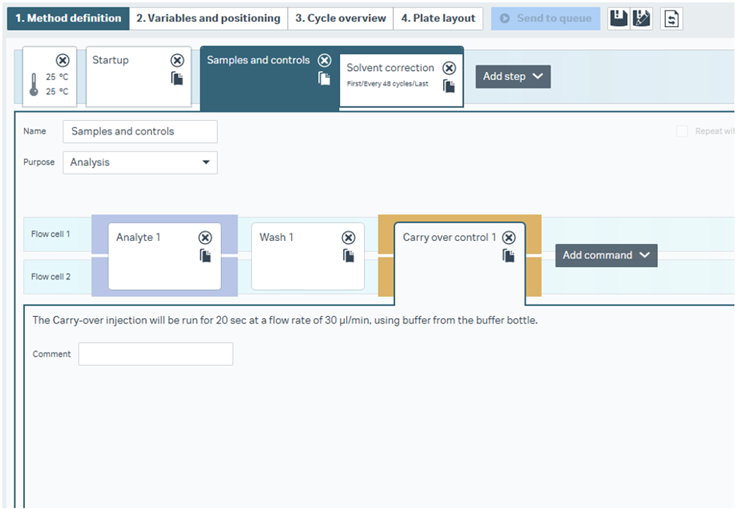
Figure 1
Figure 1 はLMW screenのテンプレートを開いたところです。LMW screenでは、標的タンパク質を大量に固定化したセンサーチップの上に、次々と異なるアナライトをひたすら添加して、そのbinding lateなどのレポートポイントの高低で候補化合物をセレクションする方法です(参考:必見!Biacore™戦略と測定条件のワークフロー)。
”Carry over control 1“ のコマンドのコメントを見てみると、30 μL/minの流速で20秒間、バッファーボトルから吸い上げたランニング緩衝液を添加する、と記載されており、作業者が変更を加えられる項目はなさそうです。当然、ランニング緩衝液を添加しているだけですからレスポンスは何も出ないハズ…ですが、もしstickyな化合物が残留しているとランニング緩衝液の添加で押し出され、レスポンスが見られるようになります。
こうなるとそのサイクル以降のデータは信頼性が低い可能性があります。場合によっては再測定となるかもしれません。このCarry-over controlでレスポンスが見られてしまうようなstickyな化合物は候補化合物のセレクション後の詳細解析(kineticsとかaffinity解析など)には持ち込まない(あるいは別に測定する)のが良いでしょう。
因みに下のFigure 2 はLMW single-cycle kinetics using Biotin CAPture kitのテンプレートですが、ここではCarry-over controlのコマンドは入っていません。もうstickyな化合物は除外されていることが前提だということですね。
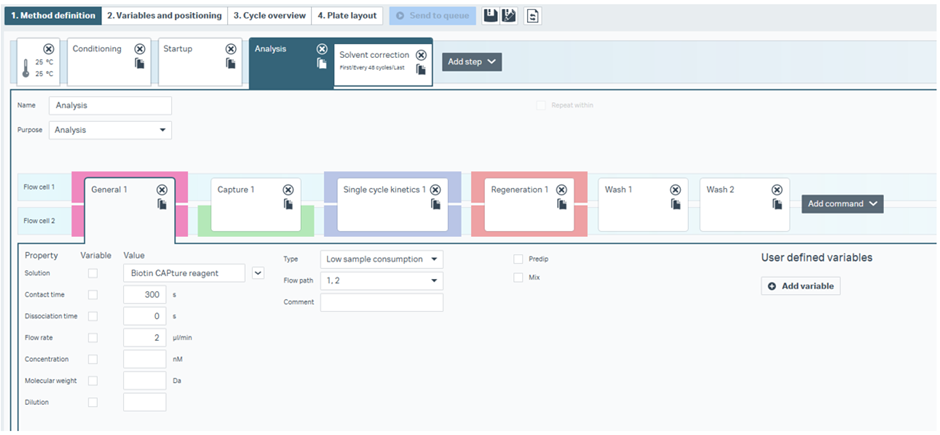
Figure 2
Carry-over controlでstickyな化合物があるかどうかは分かったが…どう対策する?
これが今回の本題、Extra washです。Extra washはサンプルを添加する全サイクルにおいて、サンプル添加後に50% DMSOなどをフローシステムに流すコマンドです。あえて触れていませんでしたが、Figure 1 にもFigure 2 にも、Wash 1やWash 2というコマンドが入っていることがご確認いただけると思います。LMW screenのWashコマンドを Figure 3 で確認してみます:
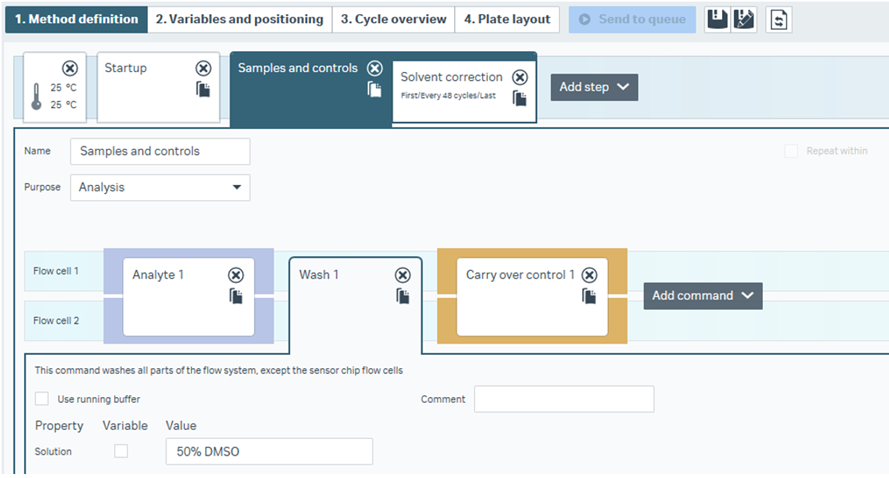
Figure 3
「50% DMSOなんか流したら、センサーチップ表面に固定化された標的タンパク質が破壊されてしまうのでは?!」と思われるかもしれません。その発想はごもっともです。しかしこのWashコマンドでは、「センサーチップ表面を除くフローシステム全体に添加する」操作となりますのでご心配ご無用です。流路中に残留するstickyな化合物を50% DMSOで押し出して次のサイクルに影響しないようにしているんですね。よく見ますとCarry over controlのコマンドはこのWashのコマンドの後に入っていますから、50% DMSOによる洗浄にも耐える、本当に厄介なstickyな化合物を検出するということが分かります。やっぱりスクリーニングの段階で除外しておくのが吉、と言えそうです。
因みにFigure 2 で出てきたWash1ではランニング緩衝液を添加しています。これはBiotin CAPture Kit使用時に特有のExtra washのコマンドであり、高分子の測定のテンプレートにも組み込まれています。Regeneration 1 のコマンドで添加される再生溶液である「グアニジン塩酸塩と水酸化ナトリウムの混合溶液」が大分ハードな溶液なのでランニング緩衝液を流さないと次のサイクルに影響を及ぼしてしまうので加えられています(よく見ると、Conditionのstepでも最後に入っています)。Wash 2 はここまでのご説明通り50% DMSOです。
まとめ:Extra washのコマンドはいつ実施されているか
- 化合物を添加するたびに50% DMSOで実施し、流路への残留を抑制します。これはscreenだろうとkinetics測定のようなcharacterizationだろうと、溶解性の悪いサンプルを流すなら必須で実施します。
- Biotin CAPture Kit使用時のような、特殊な場合はランニング緩衝液によるExtra washが含まれることがあります。
- (今回は特にご紹介していませんが)Sensor chip SAなどにビオチン標識サンプルを固定化する際にも50% Isopropanol/1M NaCl/50mM NaOHによるExtra washが入っています。
- (これはかなりレアケース)抗抗体を固定化したチップに抗体をキャプチャーする方法の際にもまれにキャリーオーバーすることがあります。その場合、抗体をキャプチャー後に50mM NaOHによるExtra washを行います。
以上のように、キャリーオーバーを抑制する目的でExtra washが含まれていました。実は、キャリーオーバー(&コンタミネーション)を抑制する方法はもう一つあり、Predipと言います。こちらは次回のコンシェルジュにてご案内の予定です。お楽しみに!