HisTrap™ でどのようにHisタグタンパク質は溶出されているのか?
溶出溶液の中には例えばHiTrap™ Protein Aカラムのように酸を使ってタンパク質の構造を一時的に変化させて溶出させるようなものもありますが、HisTrap™ の溶出溶液のイミダゾールは目的のHisタグタンパク質とNiキレート結合部位と競合することで溶出する原理です。
ここで一つ重要なことは“競合”による溶出というのは、あらかじめNiキレートに結合しているHisタグタンパク質を、イミダゾールが力づくではがしたところに結合する、という作用機序ではないということです。HisTrap™ はそのカラムの中で一見がっちりとHisタグタンパク質を捕捉しているように思えます。
実際、補足されたHisタグタンパク質はイミダゾール溶出をする前に、カラムから漏れ出てくるわけではありませんのでそう考えるのも無理はありません。ところが、実際はHisTrap™ 上のNiキレート結合部位の一つ一つとHisタグとの間のアフィニティは一般的に低く、一回捕捉されてもすぐ外れてしまうのです。ではなぜHisTrap™ ではがっちり捕捉されているように見えるかをご説明したいと思います。
まず、カラムの中には無数のレジンが存在し一つ一つのレジンにはまた無数のNiキレート結合部位が存在し、Hisタグタンパク質をキャパシティ内の量をアプライしても、多くのNiキレート結合部位はタンパク質を捕捉していない状態にあります。ここで図1のように最初にレジンAに結合しているHisタグタンパク質がその弱いアフィニティのため外れても、すぐ隣にある担体Bに再結合するということが起こります(図1)。
つまり微視的にはこのようについたり離れたりしていますが、巨視的にはカラムという空間の中で捕捉され続ける、ということが起こっています。
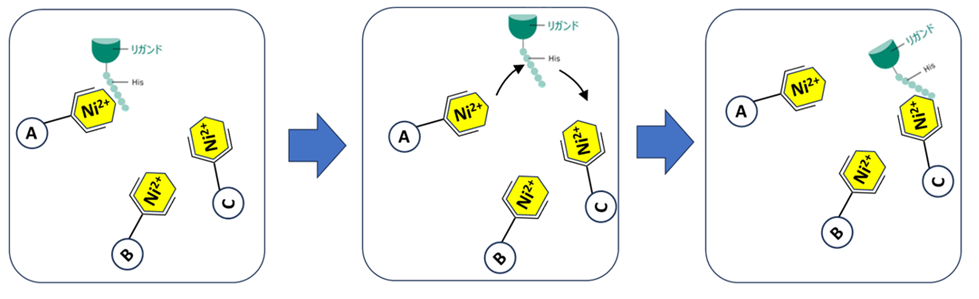
図 1
図1の真ん中の状態でもし大過剰のイミダゾールが添加され担体A, B, Cがすべてイミダゾールでふさがれてしまったらどうなるでしょうか。
そうです、Hisタグタンパク質はもはや再結合する場所を失うので、溶出してくる、ということになります。これがHisTrap™ でのイミダゾールが結合部位を競合することによりHisタグタンパク質が溶出する機序です。
まとめますと、HisTrap™ 上のNiキレート結合部位とHisタグタンパク質の量的な関係は
Niキレート結合部位 ≫ Hisタグタンパク質
となり、そのためカラム内の空間で再結合を繰り返して捕捉されており、イミダゾールそでその再結合を阻害することで溶出している、ということになります。
SensorChip NTA上でどのようにHisタグタンパク質は捕捉されているのか?
一般的にSensorChip NTAを用いたBiacore™ 測定の場合は、この量的な関係は
Niキレート結合部位 ≧ Hisタグタンパク質
になり、捕捉されたのち一度解離したHisタグタンパク質は再結合しないか、ほとんどすることがなくセンサーチップ上から廃液へ流れ出します。この様子はBiacore™ のセンサーグラム上でHisタグタンパク質が経時的に外れることによる右肩下がりのベースラインドリフトとして観察されます。
いわば、図1の左の図のA、B、Cの場所がすべてあるいは多くはHisタグタンパク質で埋まっていて、一度解離したら、再結合する場所がBiacore™ の検出範囲内に全くないかあまりない、という状況なのです。
SensorChip NTAの再生溶液はなぜイミダゾールではなくEDTAなのか?
先に述べた通り、イミダゾールはHisタグタンパク質を力づくではがして置き換わるという作用ではないので、イミダゾールでSensorChip NTAからHisタグタンパク質を解離させることは、ほぼできないことがご理解いただけるかと思います。
再結合しないので、待っていればそのうちすべてセンサーチップ上から勝手に解離してくれるのですが、それでも何10分なりの、Biacore™ 測定の1サイクルの時間から考えると相当に無駄な時間を費やしてしまうわけですので、速やかに解離させるためにNiをNTAから奪い取るEDTAを再生溶液としてBiacore™は採用しています。