おさらい
※本記事ではフラグメントを300 Da以下程度の小さい分子と定義しています。標的タンパク質との親和力は弱いため、センサーグラムは典型的な箱型になります。低分子のスクリーニングはワークフローが異なりますので混同しないようご注意ください。
2021年に配信しましたWebinarにおいて、フラグメントにおける典型的なワークフローをFigure 1のようにご説明しました。
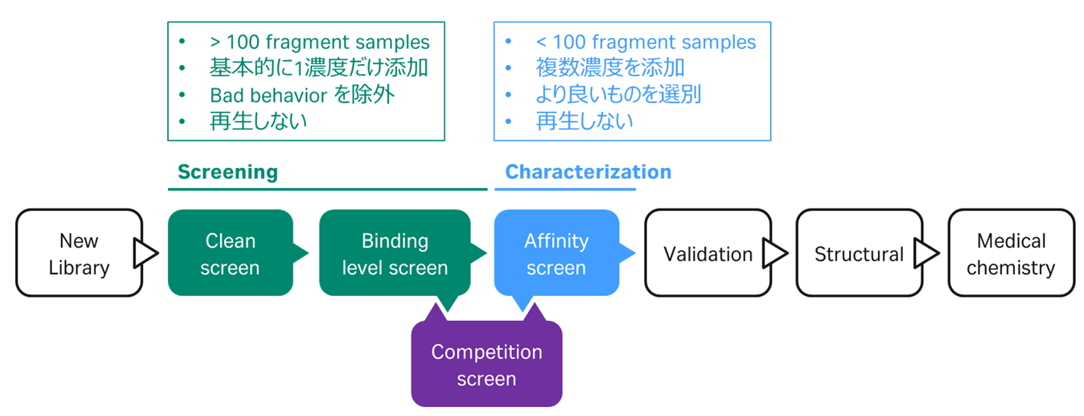
Figure 1:フラグメントにおける典型的なワークフロー
すなわち、Screening=非典型的なセンサーグラムを除外することを目的とし、再生操作を行うこともなく1濃度で様々なフラグメントを次々と添加する選別方法、Characterization=ある程度数が絞られたフラグメントを濃度条件を振って詳細解析、という流れです(因みにCompetition screen=選択性の検証です。詳細はこちらをご覧ください)。Screeningは更に2つに分かれており、Clean screen=ベースラインに戻らないものを除外、Binding level screen=箱型でないものを除外、という2ステップで選別されるのでした(Figure 2,3)。
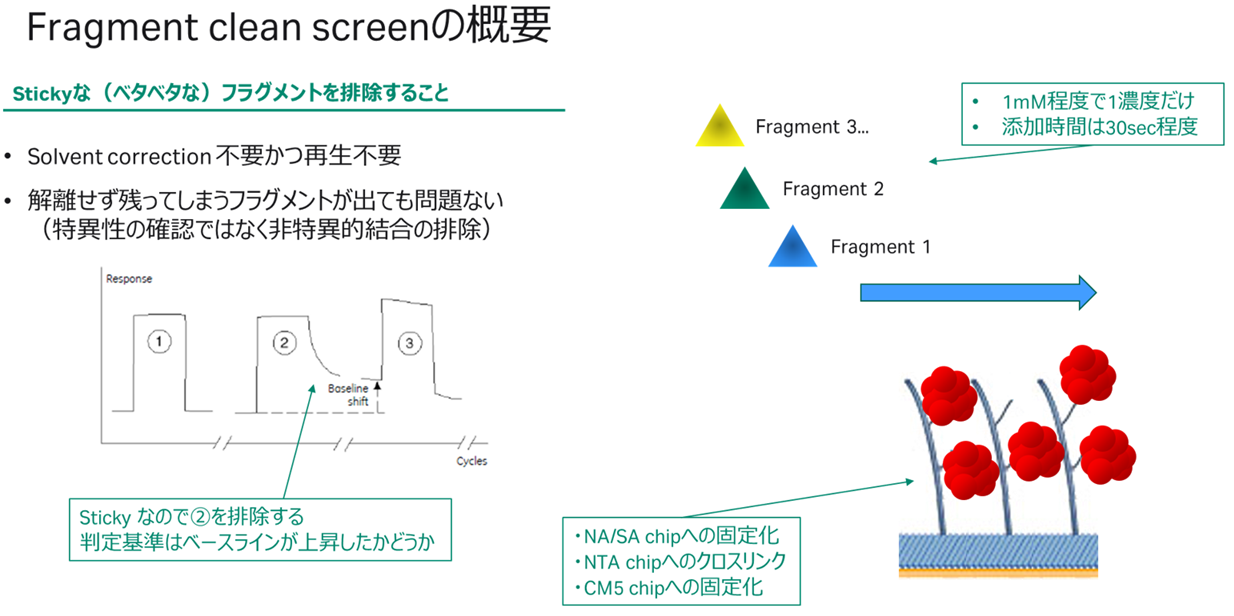
Figure 2:Fragment clean screenの概要
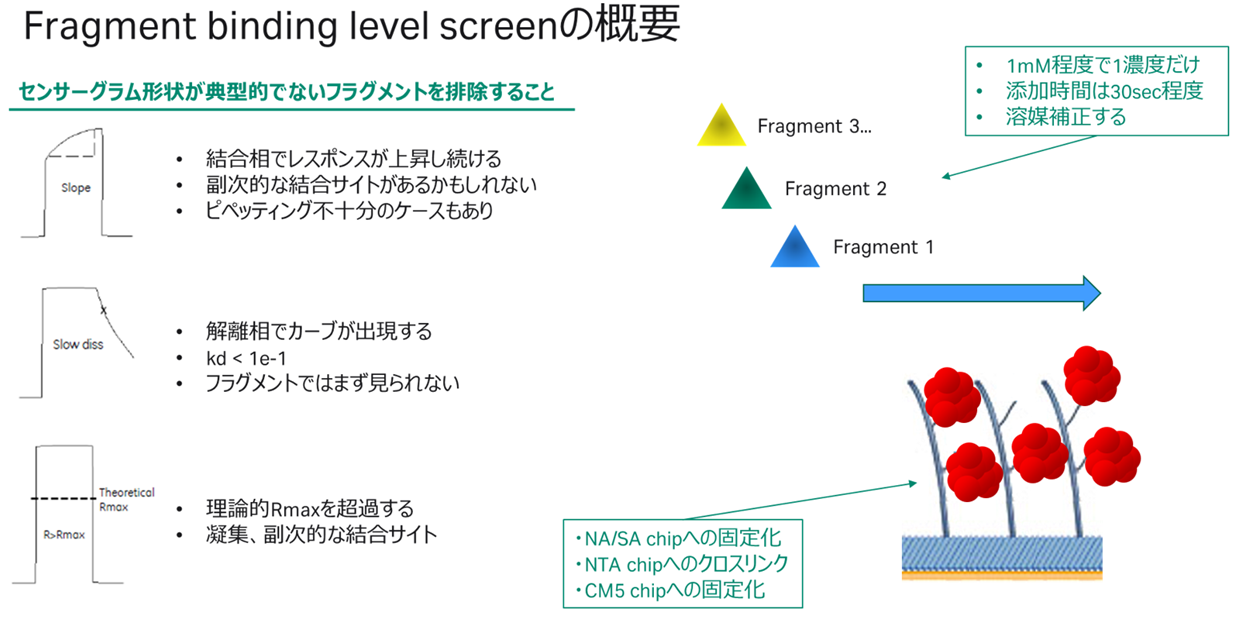
Figure 3:Fragment binding level screenの概要
複数濃度でのスクリーニングの意義と実例
さてこれまでご紹介してきた1点のスクリーニングは効率性に優れる一方、やや高い偽陽性率、偽陰性率が課題でした。今回ご案内する複数濃度でのスクリーニングは効率性を犠牲にこれらを改善するものです。Giannetti, AM. Methods in Enzymology, Volume 493, 2011では6000フラグメントを2つの濃度でスクリーニングすることで、750以上のサンプル(ライブラリーの12.5%にあたる)が偽陽性として同定されたことを報告しています。
具体的な測定方法はACS Med Chem Lett. 2010 Feb 4;1(1):44-8にまとめられております。こちらではSensor Chip CM5上に固定化されたCarbonic anhydraseⅡに対して3点濃度(16.6, 50, 150 μM)でのスクリーニングを実施しています。Reference cellにはSAP2kというネガティブコントロールタンパク質が固定化されていることが特徴で、上述のワークフローのようにセンサーグラムの形状ではなくリガンド効率(LE)を指標にしてcutoff値を決め、解析を実行しています。
- 高濃度ほど非特異的結合が検出されやすくなる
- ネガティブコントロールサンプルのReference cellへの固定化とそのレスポンスの差し引き
- LEを考慮した平衡値の算出と差し引き
上記3点をポイントにBiacore™ T100だけでも偽陽性を限りなく排除した信頼性の高いスクリーニングを実施可能であることを示しています。
いかがでしたでしょうか?この論文が出た当時にはまだ存在していなかったBiacore 1 seriesやBiacore™ 8 seriesなど、プレートを置ける枚数やフローセル数、スループットが改善されたシステムだからこそ、効率性を犠牲にせずにより信頼性の高いデータを取得できると言えます。新たな角度からフラグメントスクリーニングをご検討いただけますと幸いです。