GxPの全体像
規制当局は、医薬品開発・製造企業に対し、品質が保証された機器を使用し、詳細かつ入念に文書化された分析・製造手順に従うよう、厳しい要求を課しています。このような規制の目的は、市場に出回る医薬品の一貫した信頼できる品質を担保することであり、その中心となるのが米FDAです。米国以外の国では、FDAに準じた規制が行われています。機器の適格性評価(Qualification、機器の品質保証)は、分析機器や製造機器がメーカーの仕様に沿って確実に機能することを目的としています。
弊社がBiacore™のオプション製品として提供するGxP PackageあるいはGxP extensionは、対応する装置のインストールとサービスメンテナンスに関連した適格性評価サービスを提供し、機器の適格性評価に必要な書類を提供します。
21 CFR Part 11と呼ばれるFDAの規制は、コンピュータベースの分析および製造手順の電子文書化に関する規制で、電子記録が完全かつ不可侵であることを補償することを目的にしています。GxP PackageおよびGxP extensionでは電子記録に関する21 CFR Part 11の規制に対応しています。なお、現在のバージョンでは電子署名はサポート外となっています。
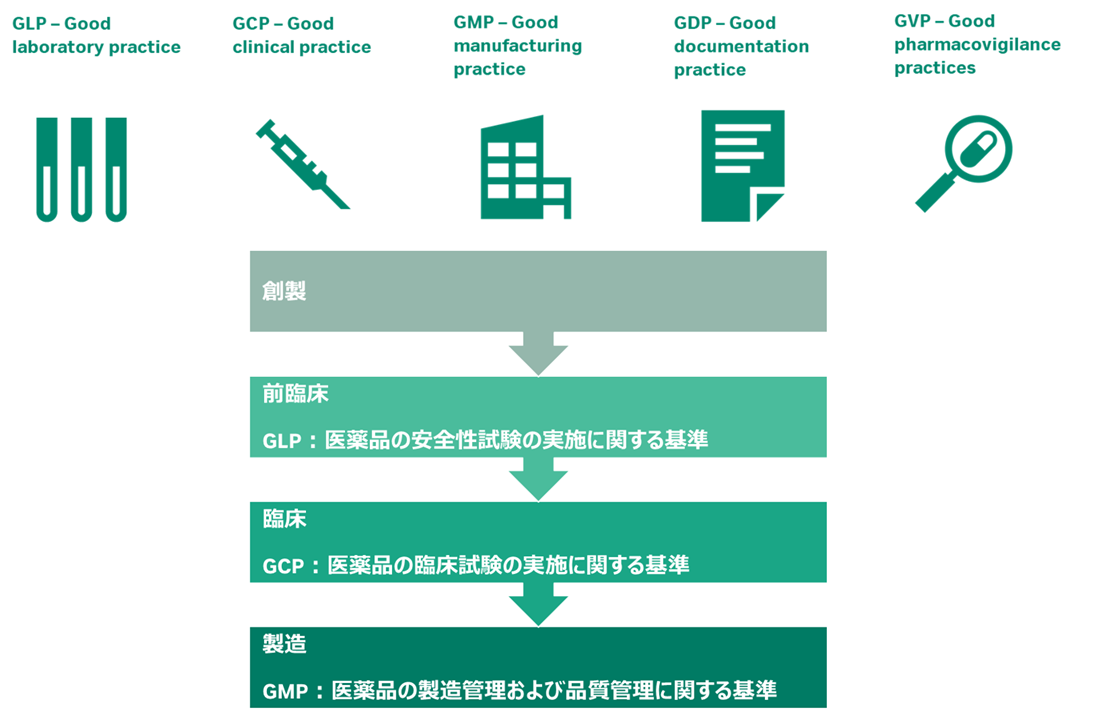
GxPとは?
Good “x” Practice の総称です。xには製品のライフサイクルの段階を示す英単語が入ります。安全性や信頼性を確保することを目的に、政府などの公的機関で制定しており、医薬品の研究、開発、試験、製造、流通の様々な分野を管理する一連の法律、規制、ガイダンスのことを指します。日本では厚生労働省が、アメリカではFDAが定めています。代表的なものは以下の5つとなります。
このうち、研究開発部門で意識されるべきはGLP、GCPです。これらはその医薬品の有効性・安全性の検証に焦点が当てられています。一方で製造部門(工場)ではGMPとなります。医薬品が有効性・安全性が確保された手順で製造されているかどうかに焦点が当てられています。
FDA 21 CFR part 11 とは?
アメリカFDAが、食品、医薬品、医療機器、その他の消費者関連製品の安全、衛生に関して制定し、CFR(Code of Federal Regulations;連邦規則集)第21編(Title 21;食品、医薬品関連)として連邦官報(Federal Register)で公示された規則(Rules & Regulations)を言います。そのPart 11は、電子記録による作成資料のコンピュータバリデーションに関する部分で、1997年に発行されました。このPart 11はおおよそ以下のように記載されています(詳細は元資料をご確認ください)。GxP Packageではこれについてフォローされています。
電子記録
- 電子記録の保存に際し、将来システムが変更されてもデータの検索と読み出しが可能であるデータ変換機能を持つこと。
- データの保存管理の操作については、個人の操作に制限が欠けられること。すなわち、電子記録されている記録データについて「表示だけできる」、「データを保存できる」、「データを変更できる」などの操作制限を設定できること。
- 電子記録にかかわりのある運転データの操作に関しては、操作者、操作内容、操作日時が自動記録されること。記録の改竄ができないようにすること。記録の修正、削除は履歴として残すこと。記録されたデータについては、記録されている内容の検索、表示などの検証が可能であること。
- 全てのメンテナンス記録を完全に残すこと。
電子署名
- 生体測定(指紋照合など)に基づかない電子署名の場合には、「操作者の識別コード(IDコードなど)」、および「パスワード」のように、少なくとも2種類の明確な識別要素が使用できること。
- 識別コード、パスワードについては次の要件を必要とする。
- A) 必ず本人が使用しなくてはならない
- B) 本人以外が使用できないような設計になっていること
- C) 定期的に点検が実施されること
GxP Package(GxP extension)とは?
GxP Packageとは、Biacore™ T200 Control softwareおよびEvaluation softwareのGxP適合関連業務をサポートする機能を付加するものです。GxP環境下で使用する場合、このパッケージに含まれるソフトウェアの機能は、別途提供されるシステム適格性サービス(System Qualification Service)の実施により補完されます。
GxP extensionもGxP Packageと内容的には同等です。GxP extensionはBiacore™ 8K/8K+ に対応したサポートを提供します。
対応するシステムはどれですか?
2021年9月現在、Biacore™ T200とBiacore™ 8K/8K+にそれぞれGxP Package、GxP extensionが対応しています。
GxP Packageの構成物
- Biacore™ GxP Software(2 licenses)
- Technical controls for 21 CFR Part 11
- GxP Handbook
explains the functionality of the software and how to utilize this - Biacore™ T200 recommended configuration of OS for 21 CFR part 11 compliance
a guide for how to set-up computer and operating system in a good way from a compliance perspective
- GxP Documentation
- Biacore™ T200 system assessment report
describes the technical functionalities implemented in the Biacore™ T200 Software for the regulated company to comply with 21 CFR part 11 - Biacore™ T200 Software conformance certification
Certifies that the software was developed in accordance to an approved development model - Biacore™ T200 Hardware conformance certification
Certifies that the software was developed in accordance to an approved development model
- Biacore™ T200 system assessment report
Biacore™のQualification(適格性評価)の全体像
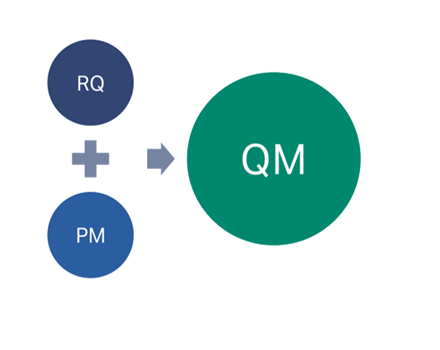
Biacore™システムが設置されたときに、適格性評価のためIQ/OQ/PQを実施します。システムの性能はIPQ testを実施することで検証されます。システムは弊社技術サービスによる定期的なメンテナンス(PM: Preventive Maintenance)と、それぞれのメンテナンスの際にIPQ testを繰り返し実施することで装置はRe-qualified(RQ)され、これにより ”qualified state” の状態が維持されます。
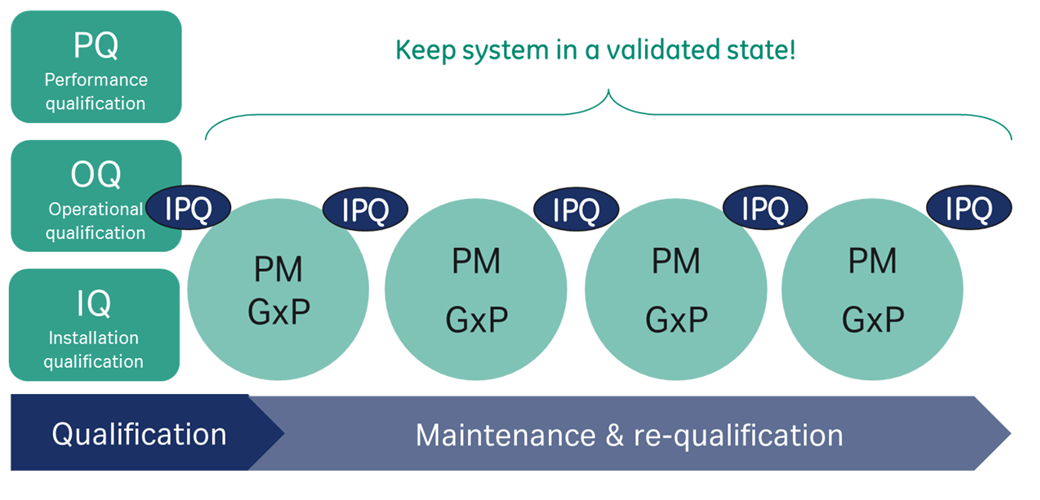
すなわち、Qualification maintenance(QM)とは定期的なメンテナンス(PM)を受け、IPQ testによりRe-qualified(RQ)された装置により成立します。
装置をGxP環境で動かしたいと思ったとき、必要なものは何ですか?
1年目と2年目以降で異なります。具体例とともに見ていきましょう。
※以下に掲載されている価格は、2021年9月時点の消費税抜きの希望小売価格を表示しています。なお、希望小売価格は単なる参考価格であり、弊社販売代理店が自主的に設定される販売価格を、何ら拘束するものではありません。
1年目
| コード番号 | 製品名 | 内容 | 価格(円) |
|---|---|---|---|
| 28977954 | Biacore™ T200 GxP Package | ソフトウェア(永続)+ システム適格性評価ドキュメント | 4,755,000 |
| 29267094 | Binder IQOQ Biacore™ T200 | IQOQの実施とドキュメント、IPQキットによる実施も含む | 583,500 |
| 28992654 | Commissioning and Qualification Performance 1 day | 作業費 | 267,800 |
2年目以降
| コード番号 | 製品名 | 内容 | 価格(円) |
|---|---|---|---|
| 29267095 | Binder RQ Biacore™ T200 | RQの実施とドキュメント、IPQキットによる実施も含む | 346,000 |
| 28992654 | Commissioning and Qualification Performance 1 day | 作業費 | 267,800 |
| 29267089 | Binder CCP Biacore™ | 稀に必要(詳細は後述) | 146,000 |
2年目以降は29192698 Biacore™ T200 PrevMaint(点検、価格1,080,000)も必要ですが、通常は保守契約内に含まれているはずですので除外しました。単品でご購入の場合は別途出張費作業費が加えられます。
Biacore™ 8K/8K+の場合は以下のようになります。
1年目
| コード番号 | 製品名 | 内容 | 価格(円) |
|---|---|---|---|
| 29332212 | Biacore™ Insight Evaluation Software, GxP Extension, Permanent Single License | ソフトウェア(永続)+ システム適格性評価ドキュメント | 1,041,000 |
| 29267090 | Binder IQOQ Biacore™ 8K/8K+ | IQOQの実施とドキュメント、IPQキットによる実施も含む | 908,400 |
| 28992655 | Commissioning and Qualification Performance 2 days | 作業費 | 535,500 |
2年目以降
| コード番号 | 製品名 | 内容 | 価格(円) |
|---|---|---|---|
| 29267091 | Binder RQ Biacore™ 8K | RQの実施とドキュメント、IPQキットによる実施も含む | 438,400 |
| 28992655 | Commissioning and Qualification Performance 2 days | 作業費 | 535,500 |
| 29267089 | Binder CCP Biacore™ | 稀に必要(詳細は後述) | 146,000 |
GxP ServiceのIQ/OQ/IPQ … Qualification(適格性評価)について
IQ(Installation Qualification):据付時適格性評価
設計および仕様通りに装置が納品されたこと、選択された設置環境下に正しく設置されたこと、またその設置環境が装置の使用と操作に適していることを立証するものです。
- システムの確認
- 設置環境
- 設置場所
- プロセッシングユニットの据付
- 装置の製造番号の検証
- ソフトウェアのインストール etc.
OQ(Operation Qualification):運転適格性評価
Biacore™システムが、適切な環境下で操作され仕様通り機能することを検証します。
- システムの確認
- プロセッシングユニットの操作
- システムコントローラーの操作
- 運転性能
- 「プロセッシングユニットの操作」では、通電、Control softwareとシステム間の通信、Sensor chip の挿入、ラックドライブキャリブレーション、Pnuematic test、温度、Prime、Normalizeなどが確認されます。
- 「運転性能」では、System check、IPQ(Initial Performance Qualification)が実施されます。
IPQ(Initial Performance Qualification):初期性能適格性評価
Biacore™システムの機能が、運転規格に適合しているかを確認します。IPQ Kitを使用し、専用のプログラムに従ってテストを行います。
- IPQ Kitの内容
- Biotin antibody solution、Regeneration solution、Mix solution、Normalization solution
- ビオチンがあらかじめ固定化されたSensor chip
- Plastic pipettes、vials and caps、96 well microplate
- テスト内容
- フローセルテスト
- サンプルインジェクションテスト
- ミックステスト
CCP(Change Control Procedure)
GxP利用者が実施するプロセスや操作に変更があった場合どんな時でもChange Controlが報告される必要があります。System checkにより発見された装置のパーツの不具合などで交換される場合などが主な例ですが、他にもソフトウェアのバージョンアップやPCのOS変更時などにも必要になります。
今回のGxP特集①はいかがでしたか?特集②は実践編とも言うべき測定・運用上の知識についてお伝えしていく予定です。