多くの皆さまがHisタグを用いたリコンビナントタンパク質で実験をされていると思います。となりますと精製に使われるHisTrap™と同じ原理のセンサーチップNTAで、というのが真っ先に思いつくことだと思います。でもちょっとここで俯瞰的にさまざまな選択肢を見たうえで考えてみませんか?
Biacore™の測定法の構築で一番の考えどころといえば固定化アプローチをどのようにデザインするか、ですね。今日多くの方が古典的なアミンカップリング法に代わってさまざまなキャプチャー法を利用した固定化をされています。
キャプチャー法は固定化に伴ってリガンドが失活するリスクも低いですし、再生条件の検討も多くの場合で必要ありませんので自然な流れかと思います(アミンカップリングも使えるときはいい方法なのですが)。
中でもHisタグは多くの方が使用しているタグになりますのでいろいろなアプローチがこれまで試されています。センサーチップNTAとNTA Reagent kitを用いた方法は最も初期から利用されている方法で現在でもよく利用されている方法です。
でも実際使ってみるとうまくいかなかったり、最初から別の方法の方が良かったかもしれなかったようなこともしばしば起こったりします。
ではHisタグタンパク質に適用できるいろいろな固定化アプローチを俯瞰的に見たうえで、ご自身の試料や測定目的に対してどのような固定化アプローチをデザインするのが良さそうなのか理解するためのお話をしたいと思います。
まず、Hisタグタンパク質固定化アプローチとしてどのような方法が選択肢として上がるかを列記します。
- A. アミンカップリング
- B. センサーチップNTAを用いたキャプチャー法
- C. センサーチップNTAとアミンカップリングを組み合わせた方法
- D. センサーチップCM5とHis Capture kitを用いたキャプチャー法
- E. Biotin修飾して、Sensorchip SAやNA(ニュートラビジン)、BiotinCAPture kitを用いた方法
次にどのように固定化アプローチに優先順位をつけるかの材料となる要素を列記します。
- タンパク質の安定性:高いと分かっているか?
- 測定目的:溶媒補正を含む低分子化合物測定か?
- キャプチャー後のドリフト量(リガンドがはがれることでおこるベースラインの下降):大きい、小さい
- アナライトは非特異的結合をセンサーチップ(対照セル)に起こすか(起こすリスクを下げたいか)
- コスト
- そのほか(測定時間やサンプル消費量など)
それでは材料はそろったので、どのよう方法を使うとよさそうか、どういう優先順位をつけようかということを考える様々なポイントをご紹介したいと思います。
まず、1. のタンパク質の安定性ですが、これは主にアミンカップリングを適用するかどうかの判断指標になります。
アミンカップリングで一時的に酸性環境下さらされることや、多点でリジンなどの1級アミンが固定化に使われてしまうこと、あるいは再生に用いられる環境下で結合活性を失うかどうか、ということになります。
しかしながら多くの場合はその情報は無いことが多いと思いますので、アミンカップリングを行うということは一定の“不確実性”を持ったアプローチであることがほとんどになります。一方で成功すれば5.のコストは安くなることが多いと思います。
次に2. の測定目的です。例えば溶媒補正を含む低分子化合物測定の場合B.やD.のキャプチャー法は測定結果の誤差が大きくなるリスクがあります。
そのリスクはキャプチャー後のベースラインのドリフトが大きさに依存して大きくなります。溶媒補正サイクルで各濃度の検量線用標品を添加するタイミングが、実際の検体としてのアナライトを添加するタイミングと異なるため、検量線補正誤差が大きくなります。
ですので、低分子化合物の測定でHisタグキャプチャー法を用いる場合は、C.のセンサーチップNTAとアミンカップリングを組み合わせた方法(プロトコルご希望の方は、こちらから、またはTech-JP@cytiva.comまでご連絡ください)でドリフトをなくす方法を用いることがあります。
また、近年低分子化合物の測定ではE.のBiotin修飾する方法がよく用いられるようになっています。標的タンパクはいつもAvi-tagシステムを用いてBiotin導入をしておき、スクリーニングでは化合物の非特異的結合が少ないセンサーチップ NAを用いるという方法をルーチンのワークフローにすると長期的に数々のプロジェクトを安定的に予測可能なスケジュールで実行するためには優れた方法といえます。
リード化合物の最適化などのステップで再生操作が必要な比較的強い結合(遅い解離)の化合物が予想される場合はBiotinCAPture kitを用いることが多くなっています。
3. のキャプチャーしたときのドリフト量ですが、これもタンパク質によって異なりますのでやってみなければわからない“不確実性”を持っています。
また、B.のセンサーチップNTAを用いる場合とD.のキャプチャーキットを用いる場合でどちらがリガンドキャプチャー後のドリフト量が小さくなるかもケースバイケースです。
ただしセンサーチップNTAを用いた場合はキャプチャー量を下げることでドリフト量を小さくすることが期待できます。キャプチャー量を下げるということはアナライトの結合レスポンスが小さくなることを意味しますが、そのことを差し引いてもドリフト量を抑えることが期待できます(もちろん結合レスポンスが見えなくなるほどキャプチャー量を下げては元も子もないのですが)。
これは、センサーチップNTAが非常にたくさんのNTAをチップ表面上に有しているため、Hisタグタンパク質が一回外れても再結合するからです。この再結合はキャプチャー量が小さいほどVacantのNTAが余っているわけですから、よく起こります。その結果ドリフト量が抑えられる、ということです。Fig.1 はセンサーチップNTAのinstructionに記載されている図ですが、キャプチャー量が低いほどドリフトが抑えられているのが分かると思います。
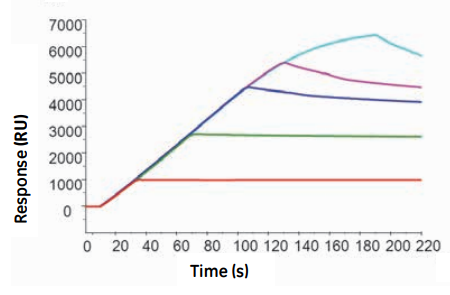
Fig.1
また、Hisタグをよく使われるHis6からHis10に変更したり、N末端とC末端をダブルHisにしたりことでもベースラインドリフトを小さくすることが期待できます。
次に4.のアナライトが非特異的結合を起こすかどうか、ということです。これもやってみなければわからない“不確実性”があることです。一般的にNTAは非特異的結合が比較的多いといわれていますので、その場合、D. のセンサーチップCM5+キャプチャーキットを使用すると改善するかもしれません。
次に5.のコストの面ですが、現在のBiacore™の消耗品類の価格はこちらでご覧になれます。これまでお話したような要素を検討されたうえでコストも考えて固定化アプローチの優先順位をつけるということになります。
センサーチップNTAは1枚当たりの単価は高額なのですが、繰り返し使用できることが期待できます。しかしながら現実上はおそらくセンサーチップの汚れの蓄積の影響なのか、徐々にキャプチャー量は落ちていくことが多いですので、永遠に使えるということにはなりません。
最後に今回ご紹介したようなたくさんの固定化方法をうまく使い分けることで、そのサンプルに対してベストの測定環境を作りこむことは重要です。
一方で今回“不確実性”という言葉を何回か使いましたが、測定が十分可能といえる範囲で“確実”に測定系の構築が可能であるという考え方も重要です。
例えば、それはルーチンでBiacore™測定を行うためワークフローを統一することで大幅に効率が良くなるようなお仕事をされている方や、逆に、たまにしかBiacore™で測定しないので、いくつも方法論を理解することはできないという方などはむしろ後者の考え方の方が重要かもしれません。
Biacore™が特に創薬の中でルーチンでご利用いただくようになってきた一方で、たくさんの方がお使いいただくようなすそ野も広がっている現在、Hisタグタンパク質であってもE.のBiotin修飾を用いたアプローチも一考の価値があり、実際に低分子化合物以外の測定でもこのアプローチが増えてきているのはそのような理由によるものかもしれません。