Biacore™はSPRを応用して作られた分析機器と呼ばれますが、ハードウェアに関してはSPR検出、センサーチップ、そして、マイクロ流路系の3つがコアな技術となります(図1)。今回、マイクロ流路系やフローセルの構造、そして、流路への様々なインジェクション方法についてご案内します。
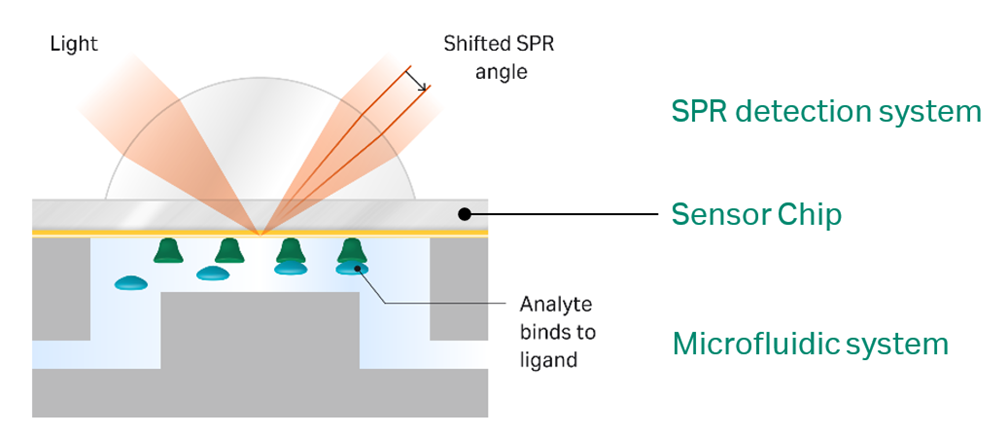
図1:Biacore™ハードウェアにおける3つのコア技術
マイクロ流路系 IFC (Integrated µ-Fluidic Cartridge)
送液にはカートリッジ形式のマイクロ流路系(IFC)を採用しています(図2)。機種にも寄りますが現行モデルでは流路の一番細いところ(フローセル部分の高さ)が40~70 µmで、1アッセイあたり100 µl程度とわずかな溶液を使用します。ニードルによって吸い上げられた溶液がIFCを流れると、その先に検出を行うためのフローセルを形成する溝があります。
フローセル部分は、図1写真のようにセンサーチップの金膜で蓋がされます。Biacore™では1枚のセンサーチップで複数のフローセルが形成されますが、その数はIFCの溝の数で決まることになります。
図1下図は、センサーチップで蓋がされたフローセルの断面図です。流路はシリコーンゴム素材でできており、エアを送ることでバルブを開け閉めして、溶液を切り替えます。バルブの開閉は瞬時に行われるためサンプルが希釈されることなく送液が行われます。
IFCはシリコーンゴム素材でできており、使用している間に劣化が生じます。使用方法や頻度にも寄りますが、半年から1年程度で交換することをおすすめします。なお、弊社サービススタッフによる有償点検を実施させていただく際、IFC交換作業が含まれます。
低分子化合物などの測定においては、ランニングバッファーにDMSOを添加する場合があります。有機溶媒はシリコーンゴム素材に影響するため、ランニングバッファーに添加するDMSOは10%以下に抑えてください。Extra Washなど、2分程度のパルスインジェクションであれば50%でも構いません。
ニードルがサンプルを吸い上げる際、サンプルバッファーとの希釈を防ぐためエアセグメントを形成してIFCへ流れます。エアセグメントはフローセルの直前のバルブの切り替えによって除かれるため、フローセル内を流れることはありません。
Biacore™ 8K/8K+ を除いて、サンプルは一旦サンプルループに送られます。その後、サンプルループに送液された向きとは逆に、フローセルへ流れます。Biacore™ 8K/8K+では、送液のスイッチバックは起こりません。
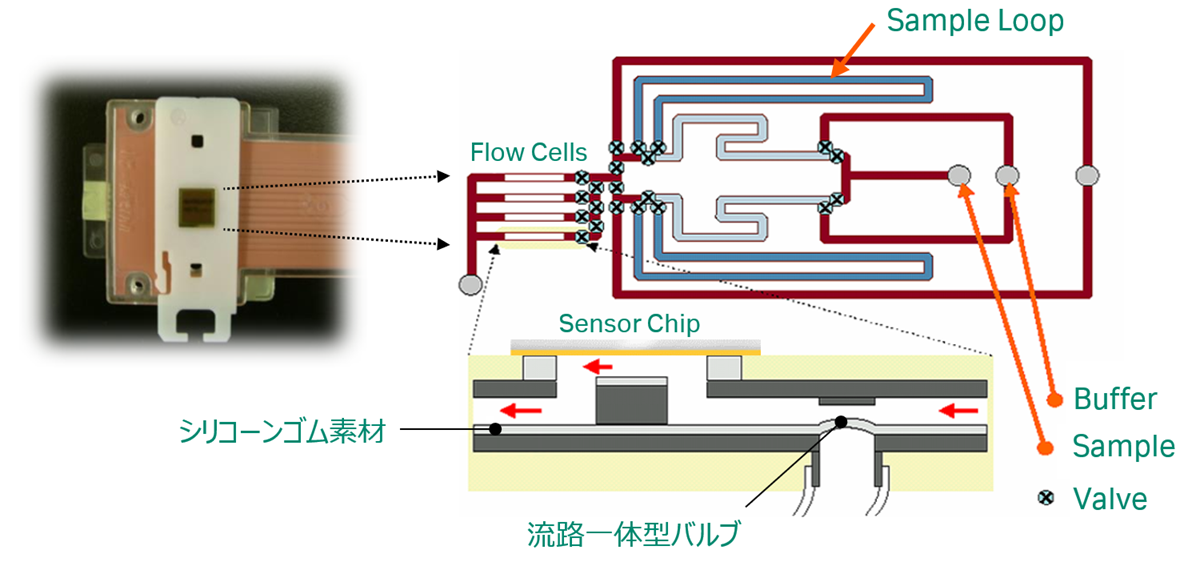
図2:マイクロ流路系 IFC (Integrated µ-Fluidic Cartridge) の構造(概略図)
機種別フローセルの違い
現行機種別のフローセル(Fc)の違いについて図3に示します。
Biacore™ 8K/8K+では、8本のニードルに対応する各チャンネルについて、それぞれ独立したFc1(Reference)とFc2(Active)の一対のフローセルがあり、計16フローセルとなります。
Biacore™ T200/S200では、4つのフローセルがあります。使用方法として、1回目の測定でFc1(Reference)およびFc2(Active)を使用し、2回目の測定でFc3(Reference)およびFc4(Active)を使用することができます。使用しないFcに送液はされません。そのほか、Fc1のみをReferenceとし、Fc2、Fc3、Fc4 をActiveとすることで、同時に3リガンドに対して測定することも可能です。
Biacore™ X100は、Fc1(Reference)とFc2(Active)が一つずつのシンプルな構造となっています。
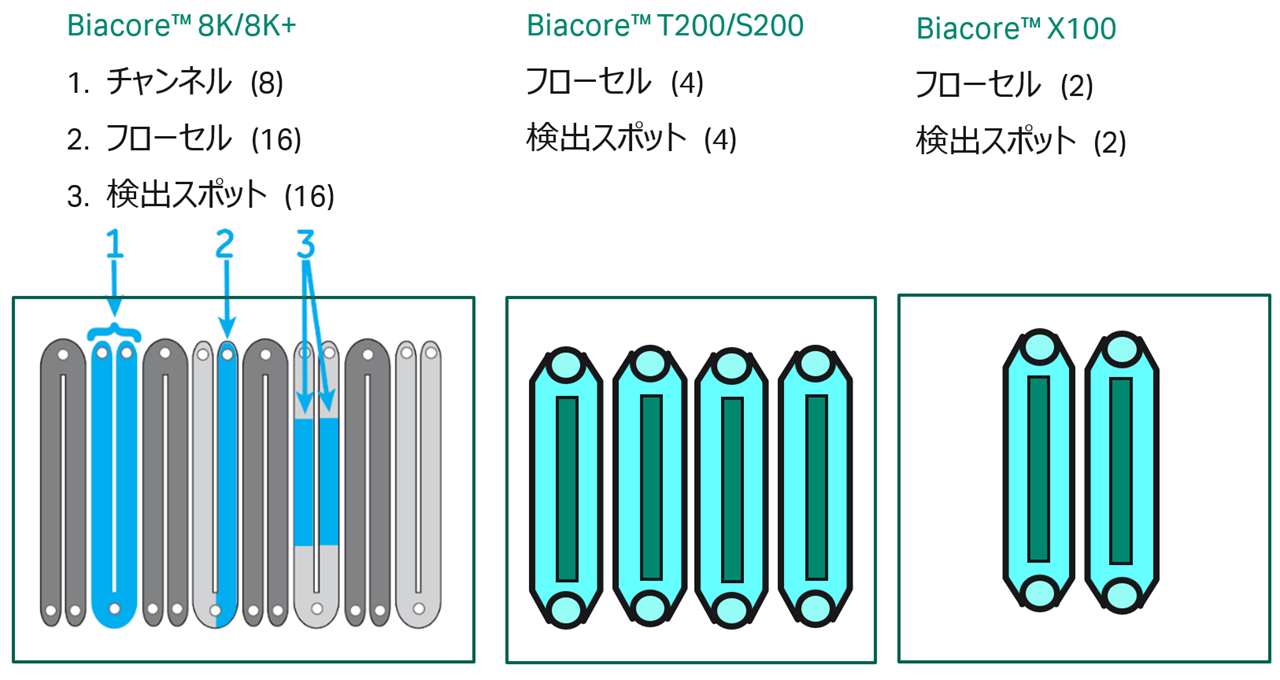
図3:機種別フローセルの違い
インジェクションタイプの選択
インジェクション方法として表1の選択肢があります。アプリケーション特有のインジェクション方法もありますが、High performance、Low sample consumptionなどは、前述のエアセグメントの回数などに違いがあります。
| General | Analyte/Sample | その他のCommand | |
|---|---|---|---|
| Biacore™ 8K/8K+ | High performance | High performance | Single cycle Kinetics |
| Low sample consumption | Low sample consumption | A-B-A | |
| Fast Injection | Fast Injection | Dual | |
| Biacore™ T200 | High performance | High performance | |
| Low sample consumption | Low sample consumption | ||
| Dual | Single cycle Kinetics | ||
| Merged Injection | |||
| Double Mix | |||
| Biacore™ S200 | High performance | High performance | |
| Low sample consumption | Low sample consumption | ||
| Dual | Single cycle Kinetics | ||
| Clean screen | |||
| Binding level screen | |||
| A-B-A |
表1:機種別のインジェクション方法。*Biacore™ X100のインジェクション方法は固定されています。
High performance(図4)
主にMulti-Cycle法によるKinetics/Affinity解析のアナライトインジェクションに用います。
サンプル吸引時に、追加のエアセグメントを設け、ランニングバッファーとサンプル溶液を十分に分離することで、インジェクション最初と最後のサンプルの拡散を最小限に抑えます。特に素早い結合・解離が見られるKinetics測定に対応するよう最適化されたインジェクション方法です。
複数のエアセグメントをつくるため、サンプルの消費量は多くなります。
Low sample consumption(図4)
主にキャプチャー用分子のインジェクションや、スクリーニングにおけるアナライトインジェクションに用います。
High performanceに比べエアセグメントが少なく、サンプルの消費量を抑えることができます。サンプルが貴重である場合、素早い結合・解離が想定されないのであれば、Kinetics/Affinity解析におけるアナライトインジェクションに用いることもできます。
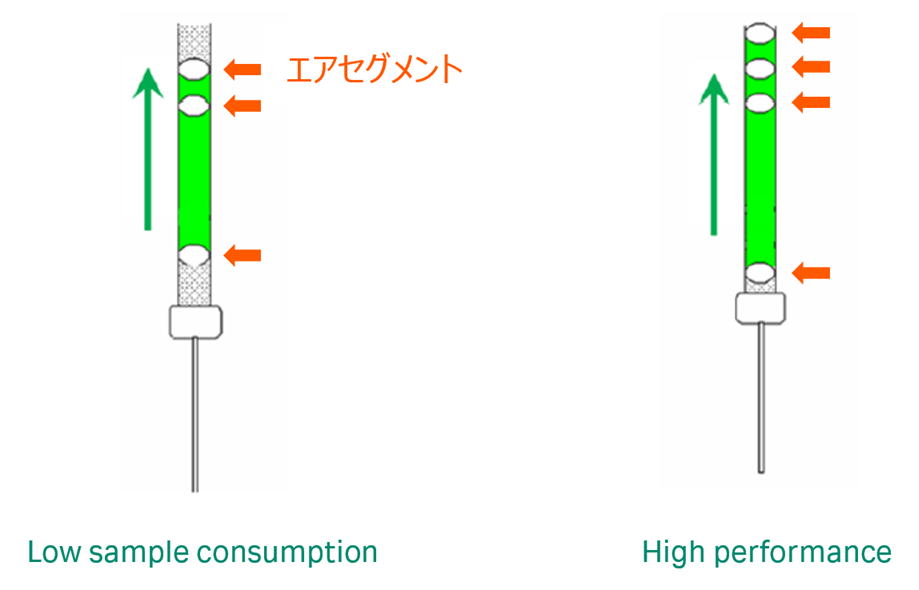
図4:Low sample consumptionとHigh performanceエアセグメントの違い
Biacore™ T200/S200において、必要なサンプル液量として30μlの違いがあります。
Biacore™ 8K/8K+では、コンタクト時間や流速に寄りますが10~25μl程度の違いがあります。
Fast Injection
Biacore™ 8K/8k+で、処理時間を最短にし、スループット重視でスクリーニングを実施するために使用します。
Extended Screening and Characterization extension packageがインストールされている場合に使用できます。Fragment Clean Screenにおいて、デフォルト設定になっています。
Clean screen
Biacore™ S200でFragment Clean Screenを実施するために使用します。
スループット重視でスクリーニングを実施します。また、インジェクション終了後に閾値以上のレスポンスが見られた場合に洗浄を実施するAdaptive Washが追加できます。
Binding level screen
Biacore™ S200でFragment Binding level screenを実施するために使用します。
スループット重視でスクリーニングを実施します。
Dual、A-B-A
ランニングバッファーを挟まずに2液を連続でインジェクションしたい場合に使用します。使用事例などの詳細は以下の記事をご覧ください。
こんな機能あったんだ(1)「Dual injection」と「A-B-A injection」Merged Injection、Double Mix
いずれもBiacore™ T200で免疫原性試験を実施するために使用します。
血清検体中の抗原と結合した抗体を検出する際のインジェクションタイプです。はじめバイアルやプレート中のサンプルに酸性溶液を添加し、抗体-抗原複合体を解離させます。その後、Merged Injectionでは、サンプルと中和溶液をインジェクションし、IFC中のフローセル直前で中和させます。Double Mixでは、バイアルやプレート中で一定時間中和させてからインジェクションします。
密閉された流路系で高精度に送液を行うことが、Biacore™で再現性のいいデータを得るためのポイントです。そのためには定期的なメンテナンスも重要です。DesorbやDesorb and Sanitizeのツールでどこが洗浄、滅菌されているのか、System Checkで何を確認しているのか、詳細を知りたい方はこちらのWebinarもぜひご覧ください。
やっと分かった!Biacore™ メンテナンスの方法と意味、トラブルシュートまで