リガンドとアナライトを入れ替えても同じ解離定数は得られる?…答えは…
本来解離定数はその相互作用固有の定数でありそうあるべきなのですが、実際には測定系に依存してそうならないリスクが大なり小なりある、ということになります。こちらのYoutubeの2分程度の動画で本件について語られていますが、本記事では抗原抗体反応、低分子、核酸の3つについてもう少し掘り下げて解説いたします。
抗原抗体反応(Avidityの影響)を考えると
まずイメージしやすいものとして抗原抗体反応を考えてみます。Figure 1は取扱説明で利用している資料を抜粋したものです。こちらにお示しした通り、(IgGに代表されるような多価である)抗体側をリガンドとするのが通常第一選択になります。
【Tips】なぜ抗原側を固定化が第一選択ではないのか?
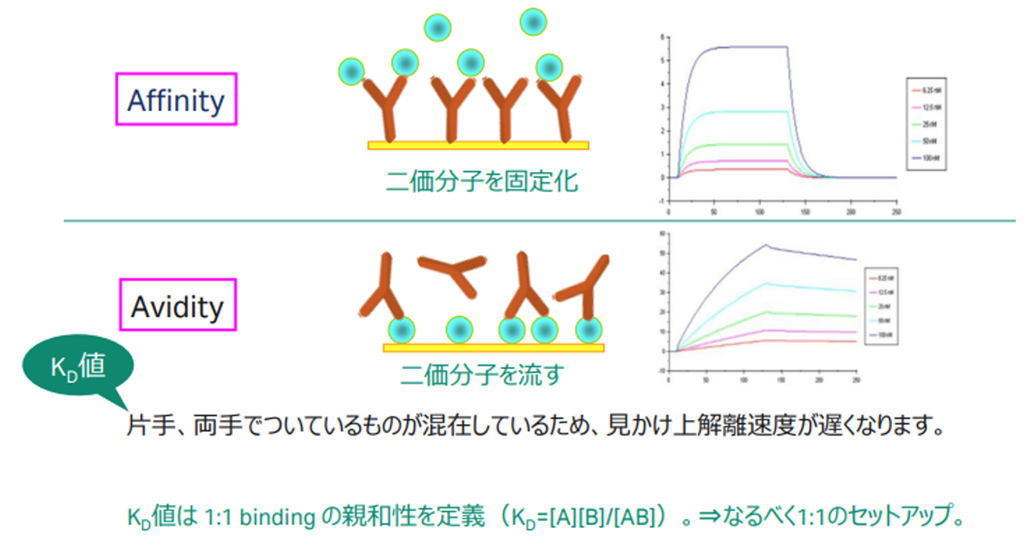
Figure 1:AffinityとAvidityの違い
なぜ抗体をアナライトにすることが第一選択にならないのでしょうか?はじめに理解しておかなければならないのは解離定数とはAffinityを指しているということです。別の表現をすれば、Avidityは解離定数とは呼びません。Affinity=KD値は1:1 bindingの親和性を定義しています。したがって、もし抗体をアナライトにした場合は、Avidityが発生しているFigure 1下の図の状況で片手の情報を抽出する必要があります。…「えっ?片手で結合しているもの、両手で結合しているものの割合も分からない上、リガンドの密度によってもセンサーグラム形状が変わりそうなのに?」…そうです、これは感覚的にも難しそうであるとすぐにご理解いただけるのではないでしょうか。
Bivalent analyte modelではka1、ka2、kd1、kdtyの値であるKD値を導き出すための結合・解離速度定数と定義されています。ka2, kd2に関しては2段階目の相互作用を表す変数と定義されていますが、この2段階目の相互作用は実際センサーチップ上ではどのような挙動をするか不明な部分が多く、意味のない数値と言えます。ですのでBivalent analyte model を適用する場合は、リガンドの固定化量をなるべく下げて、少なくとも2段階目の相互作用の割合を減らすことは検討する方が誤差が少なく同じ解離定数になるかもしれない、と言えます。
一方でそれとは別に(、1固定化に伴い、結合部位周辺の環境が変わり結合定数がは異なる可能性があります。この点はどちらを固定化しても起こりうる問題ですので、どちらが正しいという問題ではありませんが、固定化する側を変えることで解離定数が異なる原因になりえます。
これらの要因が積み重なってきますので、1:1 bindingの結合様式であったとしても、必ずしも同じ解離定数が得られるとは限りません。
低分子(官能基の変化や立体障害の影響)を考えると
続いて低分子を考えてみます。Figure 2ではタンパク質を青色の丸、低分子を橙色の三角形で示しました。
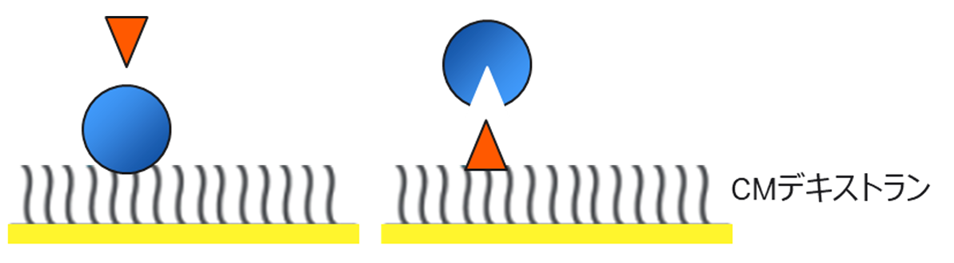
Figure 2:低分子の測定…リガンドに低分子は可能か?
Figure 2 左のタンパク質側をリガンドとするのが一般的な方法です。低分子側をリガンドとすると先に述べた結合部位周辺の環境の変化が分子サイズの小ささに比べ相対的に大きく、高分子を固定化する場合と比べ、大きく解離定数を変える要因となるリスクが高まります。
核酸(電荷の影響)を考えると
続いて核酸を考えてみます。Figure 3では核酸を二本鎖、タンパク質を橙色で示しました。
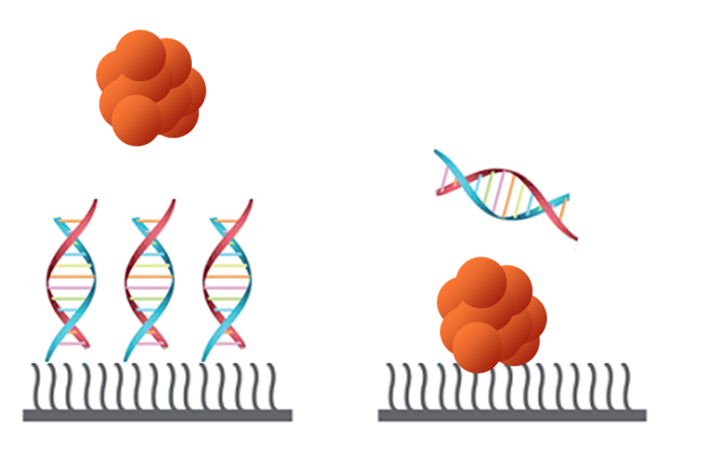
Figure 3:核酸の測定…右は不可能ではないがそもそも難しい
Figure 3左が一般的な方法です。核酸の測定で気にしなければならないのは、そもそも核酸は強い負電荷を持っているということ、およびデキストランマトリクスはCM基が中性付近で電離しているため、負電荷を帯びているという点です。したがってお互いに反発するため、Figure 3右のような相互作用は静電的反発込みでの測定となります。したがって明確にリガンドとアナライトの入れ替えでは違いが出ます。
まとめ
結論として、リガンドとアナライトを入れ替えるとその測定系に依存して解離定数は必ずしも一致しない要因がある、ということになりました。これらの要因がもたらす影響を考慮してどちらを固定化するかを設計する必要があります。