|
|||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
|||||||||||
|
Location:Home > テクニカル情報配信サービス > バイオダイレクトメール > バイオ実験の原理と方法 > クイズ |
|||||||||||
クロマトグラフィークイズ:総合編の解説(1)1M Tris-HCl pH8.0のバッファーストックがある。これを20倍希釈したものを、50mM Tris-HCl, pH8.0として使ってよい。【×】 Trisは、希釈によりpHが変化します。10倍希釈で0.05 pH下がるといわれていますので、20倍希釈では0.1程度下がってしまう可能性があります。 GST融合タンパク質のGlutathione Sepahoseからの溶出など、pHによって効率が左右されるようなケースでは特に、ストックバッファーの希釈後に再度pHチェックするようにしてください。 (2)ゲルろ過カラムで高分離を得るには、サンプル添加量はカラム体積の10%程度にするべきである。【×】 一般に、ゲルろ過カラムでのサンプル添加はカラム体積の2-5%までにすることが推奨されます。特に分離を高めたい場合、カラム体積の1%程度を目安に添加することをおすすめします。
参考(3)ゲルろ過はさまざまな条件のバッファーを分離に用いることができるので、複雑な組成をもつ初期の精製に使われることが多い。【×】 ゲルろ過クロマトグラフィーでは、分子の大きさが2倍程度離れていないと2本のピークとして得られないため、複雑な組成の初期サンプルでは十分な分離が得られない可能性があります。また、(2)の解説にある通りサンプルの添加液量に限界がありますので、液量も含有タンパク種も多い初期精製では威力を発揮しづらいといえます。 参考(4)疎水性相互作用による精製で、条件検討を実験室にある精製システムで行った。本番の精製では、失活しないよう念を入れて低温室で精製を行うことが望ましい。【×】 疎水性相互作用クロマトグラフィーでは、タンパク質分子に含まれる疎水部分とカラムの疎水性リガンドが引き合う力を利用した手法です。この引き合う力は温度によって多大な影響を受け、低温になれば疎水性相互作用が弱まります。そのため、予備実験の結果を再現するのであれば、作業環境温度はそろえる必要があります。 (5)陰イオン交換用の官能基であるQ(強イオン交換体)とDEAE(弱イオン交換体)では、Qの方が強くタンパク質を吸着させることができる。【×】 イオン交換体の強弱は、「タンパク質との結合が強い・弱い」という意味ではなく、pHによるイオン交換基の解離状態の変化の程度を表しています。DEAE(diethylaminoethyl)やCM(carboxymethyl)といった弱イオン交換体はイオン交換基の解離度すなわち交換容量がpHによって著しく変化します。一方、Q(quaternary ammonium)やSP(sulphopropyl)といった強イオン交換体では、pHの変化によらずイオン交換基の解離状態が一定であるため、交換容量も一定となります。 (6)塩化ナトリウム(NaCl)と硫酸アンモニウム((NH4)2SO4)では、塩化ナトリウムの方が塩析効果が高い。【×】 塩には、タンパク質に対して析出させる効果の高い塩と、溶かす効果の高い塩があります。硫酸アンモニウムでは、硫酸アンモニウムの方が塩析効果が高く、硫安沈殿に使用される塩として有名です。
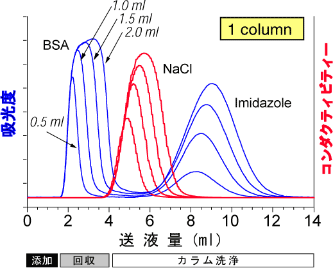
(7)GST融合タンパク質を精製後、GSTタグを酵素でカットしたとたん溶液が白濁した。原因は酵素の失活によるものである。【×】 タグなしでダイレクトに発現させると不溶画分に発現してしまうようなタンパク質でも、融合パートナーとして非常に水溶性の高いGSTのようなタンパク質を選ぶことで、目的のタンパク質を可溶画分に発現させる効果が得られることがあります。ただし、酵素でタグを切り離すと、本来のタンパク質の性質が現れますので、酵素消化中の白濁の原因は目的タンパク質の凝集であることが疑われます。この場合、タグが付いたままの状態で使用するか、またはタグを切っても可溶化できるバッファー条件をあらかじめ調べておく必要があります。 (8)Hisタグタンパク質をNi固定カラムで精製し、1.5 mlのフラクションを3本得た。ここからイミダゾールを抜くためにHiTrap™ Desaltingカラムを使う場合、カラムからの溶出は1.5カラム体積分の7.5 ml分の送液を行って、つづけて次のサンプルへ進めばよい。【×】 通常、脱塩カラムでの分離ではNaClなどの低分子物質はまとめて溶出されますが、イミダゾールはちょっと特別な挙動をします。弊社の脱塩カラムの充填剤であるSephadex™ G-25とイミダゾールが干渉し、NaClなどが溶出するよりも大分遅れて溶出します。 このため、1.5カラム体積分で溶出をやめてしまうと、カラムの中にはイミダゾールがまだ残った状態になっています。次のサンプルを添加すると、このイミダゾールと混じって溶出してしまいます。イミダゾールを完全に溶出するには、3カラム体積以上の送液を行ってください。 参考図:HiTrap™ Desaltingカラムでのタンパク質、NaCl、イミダゾールの溶出パターン
(9)イオン交換カラムにサンプルをかけるため、現在のサンプルから完全にNaClを抜きたい。サンプル量は2 mlなので、脱塩カラムPD-10で行うことができる。【×】 PD-10カラムは、脱塩・バッファー交換カラムと表記されますが、試料中から完全にNaClを除去したいケースにはお使いいただけません。充填剤のSephadex™ G-25には荷電性の官能基があり、弱くチャージした状態になっています。このため、タンパク質の表面チャージと干渉して溶出が遅れ、結局NaClと同じタイミングで溶出する現象が起こってしまいます。この現象は、バッファー中に50 mM程度のNaCl(最低でも20 mM)を入れておくことで回避できます。 なお、PD-10カラムのサンプル処理液量は、2.5 mlまでですので、この場合のサンプル液量2 mlは十分処理することができます。 参考図・NaClの有無によるタンパク質溶出位置の違い (10)Sephadex™は第二次世界大戦中に出血多量の兵士を治療するための代用血漿として開発されたデキストランを架橋したものである。【○】 参考お問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
|||||||||||
© 2025 Cytiva