
|
||
|---|---|---|
|
|
||
|
Location:Home > Products > BioProcess バイオ医薬品開発・製造用製品 |
||
バイオ医薬品製造における安全性改善の重要課題はバイオバーデンマネージメントといわれており、製品の製造コストだけでなく、品質や安全性にも大きな影響を及ぼします。mAbsの製造においては、『微生物汚染がないこと』が重要品質特性(critical quality attributes; CQAs)要求事項のリスト上位に挙げられているケースがよくみられます。バイオバーデン・インシデントによる患者への重篤な影響を避けなければならないのはもちろんですが、製造バッチが失われることによるコスト的損失もまた重大です。抗体医薬品のブロックバスターの場合であれば、1 ヶ月製造がストップすると最大で約1,000億円の収益を失う可能性があります。 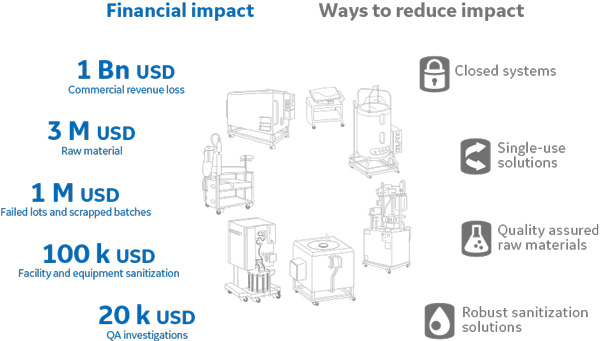
さまざまな規制機関からの最新のガイダンスでも強調されていますが、バイオバーデンコントロールのためには、微生物の混入を防ぐことが重要です*1、2、3。モノクローナル抗体の製造工程は複雑で、微生物が混入する恐れのあるポイントが多く存在します。以下はバイオバーデンが混入する可能性のある経路です。
参照
以下で一例をご紹介します。 アフィニティー担体の効果的なサニタイゼーション、および洗浄方法の検討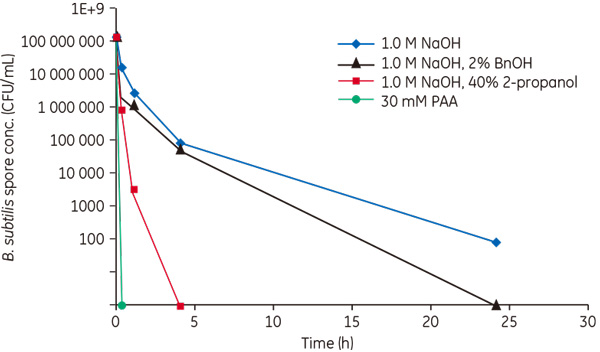 図1 Reduction of B. subtilis spores with various sanitization agents. B. Subtilis の芽胞(Spore)の減少には過酢酸(Peracetic acid, PAA™)のような酸化剤の使用が効果的です(図1)。そこで、MabSelect SuRe™(モノクローナル抗体医薬製造用rProtein A 担体)を用いた抗体精製工程の4サイクル毎に20 mM PAA™で30分間のサニタイゼーションを実施した場合と実施しなかった場合の比較を行い、以下のことがわかりました。*4
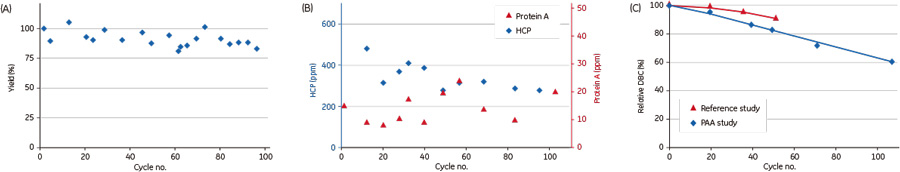 図2 Purification performance of PAA™-sanitized MabSelect SuRe™ resin compared with control(no sanitization). 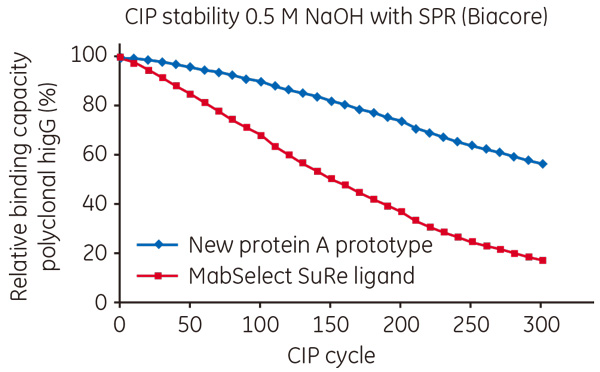 図3 Comparison of the alkaline stability of the new protein A ligand vs MabSelect SuRe™ ligand. また、サニタイゼーション手法として一般的に行われているアルカリ洗浄に関して、アルカリ耐性を高めた次世代のProtein A担体の研究も行っています。 Biacore™を使ったSPR測定の結果からは、新たなProtein A リガンドは、MabSelect SuRe™ リガンドに比べて0.5 M NaOHを使ったCIPサイクルを200回行ったときには2倍、300回の時には3倍の結合容量を維持していました(図3)。 ※4:Acknowledgement to Josh Goldstein, Janssen R&D, LLC, Malvern, PA, USA, for supply of mAB cell culture supernatant and valuable discussions. お問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
||
© 2025 Cytiva

