質問
分子量30 kDaのタンパク質を固定化し、添加アナライトとして1,000種類の化合物(フラグメント・低分子)の測定を行うBinding screenを実施したいと思います。

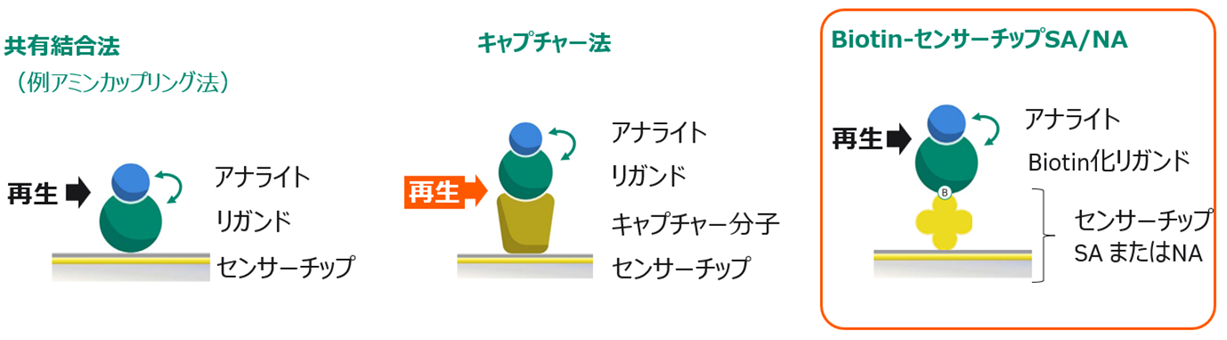
この場合、リガンドの固定化方法は、下記の3つのうち、どの方法を選択したらいいでしょうか?
- 共有結合法(例:アミンカップリング法)
- キャプチャー法
- Biotin-センサーチップSA/NA
考え方のポイント
この実験系では頻繁にリガンドの付け替えが必要でしょうか?
答え
Biotin-センサーチップSA/NAにてリガンドを固定化します。
解説
リガンドとなる分子量 30 kDaのタンパク質をビオチン化し、センサーチップSA(またはセンサーチップNA)に固定化します。
今回のケースでは、リガンドとなるタンパク質が1種類であること、アナライト数が1,000と多く、フラグメント・低分子であることがポイントです。通常、フラグメントや低分子は解離速度が速いことが多いため、アナライト添加後のリガンドの再生が不要なことが多く、速やかに次のサンプルの測定に進みます。この系は典型的なフラグメント・低分子のBinding Screenで使われます。
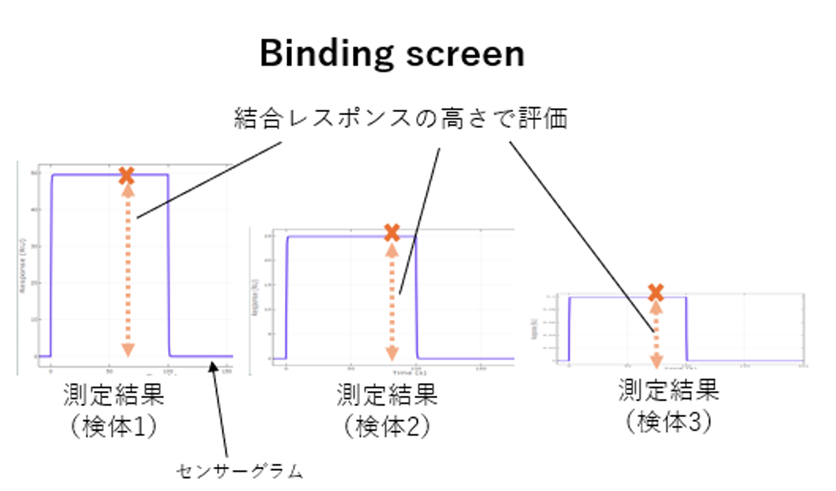
【参考】Binding screenとは?
Binding screenでは、通常、アナライト濃度1点で複数の検体を測定します。得られた測定結果についてフィッティングせず、結合レスポンスの高さで評価します。
- 本記事は、再生条件を設定せずフラグメント・低分子のBinding screenを実施するための基本的な実験系について解説しています。目的やそのほかの条件によりこれ以外の方法を取ることもあり得ます。