質問
抗体IgGと抗原タンパク質の相互作用をBiacore™で測定したいと思います。
どちらの分子をセンサーチップに固定化しますか?

考え方のポイント
抗体IgGには、抗原結合部位が何ヶ所あるでしょうか?
答え
抗体IgGをリガンドとしてセンサーチップに固定化します。
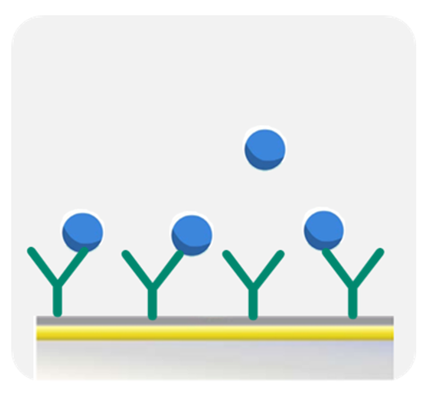
解説
抗体IgGと抗原タンパク質の相互作用を測定する場合、抗体IgGをリガンドとしてセンサーチップに固定化し、抗原タンパク質をアナライトとして添加することが一般的です。
その理由は、Biacore™の測定では出来る限りAvidityという状況を避け、Affinity(リガンド対アナライトが1:1結合)の状況下で測定をした方が、より正確なka, kd, KDを算出できるからです。
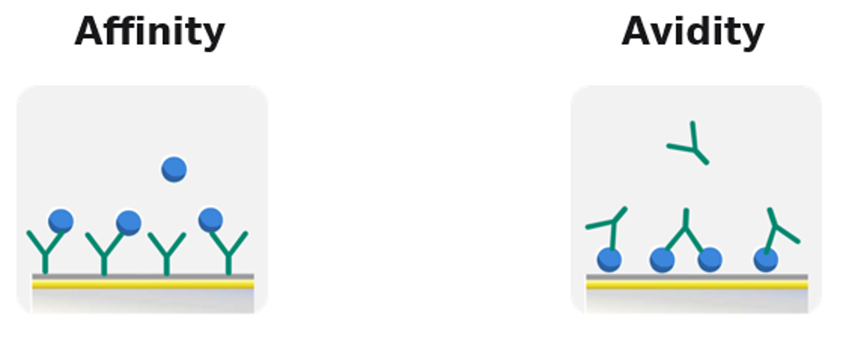
では、Biacore™の測定において、なぜAvidityを避けるべきなのでしょうか?
Avidityとは、アナライト分子にリガンドと結合する部位が複数あるため、反応の場で2種類以上のアナライトーリガンド相互作用が混在する状況のことです。例えば、抗原をリガンドとして固定し、抗体IgGをアナライトとして相互作用を測定した場合(上右図)、抗体IgGの1分子には抗原結合部位が2ヶ所ありますので、センサーチップ表面近傍では、アナライト(抗体IgG):リガンド(抗原)が、1:1または1:2の形で混在することになります。そのため、アナライトがリガンドから完全に遊離するには、複数の相互作用を解離させる必要があります。Biacore™ では結合および解離の様子をリアルタイムで測定し、センサーグラムという形で表します。Avidityが生じるとセンサーグラムは複数の相互作用の現象を反映した複雑な形状となるため、正確なka, kd, KDを算出することが難しくなります。そのため、Biacore™ の測定では出来る限りAvidityでの実験系を避け、リガンド対アナライトが1:1結合のAffinityの実験系を組むことをお勧めしています。
- 本記事はka, kd, KD を算出するための相互作用を測定・解析をするための最も基本的な方法を解説しています。目的やそのほかの条件によりこれ以外の方法を取ることもあり得ます。