第2章
サンプルの採取、安定化およびタンパク質抽出(1)
はじめに
タンパク質分析ワークフローで共通するはじめの数ステップは相互に関連し、サンプル供給源からサンプルを採取した後、安定化を行い、分析の目的に適したタンパク質集団を抽出します(図2.1)。この章ではこれらのステップに焦点を当てます。目的タンパク質を含む集団を、構造や活性を保持しながら、サンプル供給源から取り出して均一な溶液にすることが目的です。このステップで傷害が入ると、その後のサンプル調製手法や分析手法がどれほど精巧で高性能であっても、埋め合せが効かないため注意を要します。
タンパク質やタンパク質サンプル供給源はその種類によって化学的/物理的性質が異なるため、汎用プロトコールは存在しません。サンプル供給源、分析の目的および使用する手法に基づく調製方法の検討が必要です。必要となる操作内容にも大きな幅があります。例えば、尿や血漿といった体液はそれ自体がほぼ均一な、酵素活性が低いタンパク質溶液であり、採取後の調製はわずかで済みます。一方、組織サンプルは、組織構造を壊して酵素活性を抑制しタンパク質を可溶化するためにさまざまな操作が必要です。この章では、主な方法と考慮事項について概説するとともに、使用できる製品とプロトコール具体例を示します。また、サンプル供給源に含まれている非タンパク質夾雑物(核酸、脂質、多糖、フェノールなど)の除去も必要です。夾雑物除去については、DNAサイズを低減させるヌクレアーゼ処理など、一部をこの章で、主に後日ご案内する第4章で説明します。
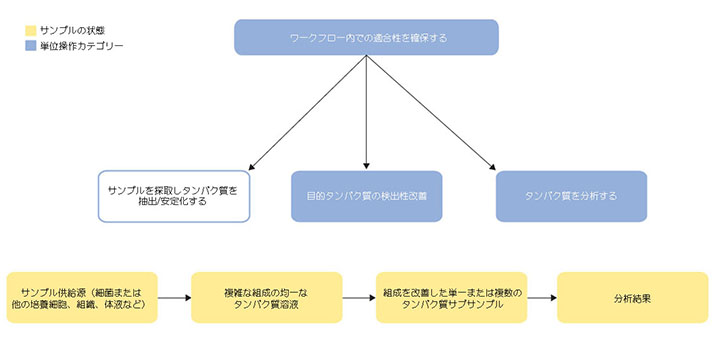
図2.1 タンパク質サンプルの調製と分析の高レベルワークフロー。この章で扱う操作を白で示します。
目的タンパク質抽出では均質で高収量であることに加え、分離されたタンパク質の質も重要です。質とはタンパク質の物理的な構造を指します。第1章で概説したように、サンプル採取およびタンパク質抽出の過程でタンパク質修飾酵素が活性化されることがあります。このような酵素を抑制しないと、目的タンパク質が分解されPost-translational modificationが変化することがあります。サンプル調製操作に使用する条件も、分解と化学的修飾の原因となることがあります。組織/細胞構造を破壊しタンパク質を可溶化するにはやや苛酷な条件が必要となることが多いため、この段階での修飾の誘発が大きな問題となります。ワークフローによっては、無傷なタンパク質が求められるだけではなく、タンパク質が活性を有するか少なくとも三次構造を保持していることが求められます。
タンパク質抽出液を調製するステップの概要
第1章で説明したように、サンプル採取時かその直後に、プロテオームの分解または変化が始まります。プロテオームの劣化に対処するストラテジーが必要であり、それには以下に示すプロセスを単独または複数で使用できます。
- 液体窒素中でサンプルを急速凍結させる
- 薬剤および/または温度でタンパク質(修飾酵素を含む)を変性させる
- 保護化合物または安定化化合物を添加する(還元剤、酵素阻害剤など)
- 沈殿によりタンパク質を安定化または不活化する
- 処理を行うときに手早く作業し、サンプルを低温に保つ
次にタンパク質を可溶化します。可溶化には、pHを制御するために適切なバッファーと、後続のプロセスに適合するタンパク質可溶化促進剤を使用します。サンプルによっては、表2.1に示す手法のいずれかを使用してホモジナイゼーション(均一化処理)と細胞破壊を行うことが必要となります。表2.1に続き、組織サンプルの小スケールのホモジナイゼーションに関するキットベースのプロトコールを示します。
その他の一般的な考慮事項としては、抽出バッファーや抽出溶媒への曝露時間、および可溶化剤のタンパク質に対する比率があります。
タンパク質の損失を避けるために、サンプル調製ストラテジーはできる限りシンプルなものとします。サンプル調節のステップを増やすことで最終的な実験結果の質を改善できる可能性がありますが、それとともにタンパク質が選択的に失われるリスクが生じます。
この章では以下のステップについて詳しく説明します。タンパク質の安定化と可溶化は、細胞構造と組織構造の破壊と同時に生じることが多い点に注意してください。
- サンプル採取
- 細胞と組織の構造の破壊
- 以下に対するタンパク質の安定化
- プロテアーゼおよびホスファターゼによる加水分解
- 酸化
- 立体構造変化
- タンパク質の可溶化
- タンパク質抽出液の清澄化
- タンパク質定量
サンプル採取
サンプル採取は、サンプリングとも呼ばれ、分析する生物系から規定の部分を引き出すプロセスです。多数のサンプル供給源が存在しますが、もっとも重要な生物モデル系は何らかの種類のほ乳動物の培養細胞、組織または体液です。組換えタンパク質の発現を分析する場合、もっとも多く使用されるサンプル供給源は各種の培養細胞(細菌、酵母、昆虫またはほ乳動物細胞)です。ハイブリドーマ細胞はモノクローナル抗体の供給源です。
細胞および組織構造の破壊
細胞や組織からタンパク質を抽出するには、タンパク質または細胞内の構成要素を取り扱えるよう、細胞と組織の構造を破壊します。抽出を左右するもう1つの要因は、目的タンパク質すべての遊離と可溶化に適した添加剤を含む溶液が同時に及ぼす作用です。また、抽出時または抽出前のタンパク質安定化についても慎重に検討する必要があります。後者の目的については以下に別途説明します。細胞と組織の構造の破壊に使用できる方法は、穏和な溶解法、強力なホモジナイゼーションと細胞破壊を行う方法、その中間的な方法に大別されます(表2.1)。溶解法では、一般に細胞に孔を開けるか部分的に破ることで、構造の一部は無傷のまま保たれます。一方、これよりも強力な方法では、一般にサンプルがほぼ完全にホモジナイズされます(高次構造がなくなります)。
可溶化液を綿密に検査して微粒子状物質を調べることで、破砕法の有効性をモニタリングします。下流ワークフローで厳密な分析を行えるように、ろ過(「タンパク質抽出液の清澄化」の回に後述します。)または遠心分離/超遠心分離により微粒子状物質すべてを除去します。例えば、固体粒子と脂質は電気泳動ゲル孔を詰まらせるため、二次元電気泳動の前に除去しなければなりません。
酵素分解などのタンパク質分解を最小限に抑えられる方法で、細胞または組織を破砕します。細胞の破砕はできる限り低い温度で、熱発生を最小限に抑えて実施する必要があります。多くの場合、プロテアーゼ阻害剤を含む溶液中で細胞破砕を行うと良好な結果が得られます。
サンプルの質を保つために、サンプルは分析の直前に調製します(または、サンプルを分取して-80℃で保管します)。
タンパク質溶液の凍結/溶解を繰り返さないでください。
このステップのデザインは、細胞内分画を行うかどうかによって大きく異なってきます。第1章に示したように、現在の分析技術は、きわめて複雑な生物サンプルを扱うには不十分で、サンプルの単純化が不可欠です。考えられる方法の1つは分析対象を絞り込むことで、例えば細胞小器官(核、ゴルジ体、ミトコンドリア、小胞体など)の細胞内構造に焦点を当てます。
細胞内分画
細胞内分画を行う場合、タンパク質抽出の手順は複数の段階を要します。まず、培養物または組織から得た細胞を溶解して細胞小器官を遊離させる必要があります。一般に、細胞小器官の破砕を最小限に抑えるたには、きわめて穏和な方法が必要となります。細胞を破壊したら、通常、密度勾配担体などを用いた分画遠心法により目的構成要素を粗精製します。得られた画分には多量の夾雑物が含まれていることが多いため、さらに分画を行うことが一般に望まれますが、全体的な収量は低下します。このような精製に使用できる方法としては、フリーフロー電気泳動法および免疫精製法があります。最後に、細胞に用いたものと同等の抽出法で、精製された細胞小器官からタンパク質を抽出します。詳しい手引きについては、参考文献1を参照してください。
表2.1 ホモジナイゼーションと細胞破壊法
| 破砕法 |
メカニズム |
典型的な条件 |
サンプル由来 |
コメント |
| 温和な溶解法 |
| 細胞溶解 |
細胞小器官の分画に有効な温和な手法 |
プレウォッシュした細胞に対し、2倍の容量の超純水を加えます。 |
Erythrocytes, E. coli (periplasmic proteins). |
プロテアーゼ遊離は抑えられますが、収量が減少します。 |
| 酵素消化 |
酵素によって細胞壁を除去 |
0.2 mg/mlになるようにlysozymeを加えます。 |
Good for Gram- positive bacteria. For Gram-negative bacteria (e.g., E. coli), combine with detergent and/or osmotic shock lysis. |
多くの場合、機械的破壊と組み合わせて使用されます。 |
| 界面活性溶解 |
界面活性剤によって細胞膜を可溶化 |
界面活性剤を含む溶解液に細胞を懸濁します。. |
Eukaryotes, E. coli. |
|
| ホモジナイゼーション |
手で持って操作できるホモジェナイザーやミキサーを用いて細胞や細胞を物理的に破砕 |
組織を細かく切り刻んでおき、必要であれば組織の3~5倍量のホモジェナイゼーションバッファーを加えます。短時間でホモジェナイズし、フィルトレーションあるいは遠心にて沈殿物を取り除きます。 |
Liver tissue, etc. |
迅速にホモジナイズされます。タンパク質が分解される危険はほとんどありませんが、破壊に伴ってプロテアーゼが遊離する可能性があります。 |
| すりつぶす |
モーターやすりこぎを使ってすりつぶす |
液体窒素でサンプルを凍結させ、粉状にすりつぶします。 |
Muscle tissue, etc. |
|
| 中間的強さの破砕 |
| ホモジナイザー |
|
機器の取扱説明書に従います。 |
Muscle tissue, most animal tissue, plant tissue. |
|
| ガラスビーズなどによるすりつぶし |
研磨剤ビーズよって細胞壁を破砕 |
プレ洗浄した1gのサンプルにつき1~3 gのガラスビーズを加え、ボルテックス、冷却、遠心を5回ほど繰り返し上清を回収します。. |
Bacteria, plant tissue. |
物理的方法。 この場合、化学的条件は、細胞の溶解にとってあまり重要ではありませんが、その後の細胞片除去と精製のステップにとって重要となることがあります。 |
| 凍結/融解 |
1回あるいはそれ以上のサイクルで素早く凍結融解を繰り替えします。 |
細胞を凍結させ、融解します(必要におおじて数回行います)。ペレットをピペッティングあるいはボルテックスで溶解バッファーに溶かし、遠心、上清を保存する。 |
|
凍結/解凍サイクルを数回繰り返すと、タンパク質の完全性に影響することがあります。 |
| 強力な破砕 |
| 超音波破砕 |
超音波のせんだん力によって細胞を破砕します。 |
バッファーに溶かした細胞溶液を超音波で破砕します。熱を避け、氷上で冷やしながら作業します。 |
Cell suspensions: intracellular proteins in cytoplasm, periplasm, inclusion bodies. |
核酸の遊離により粘性の問題が生じることがあります。その場合には、デオキシリボヌクレアーゼ(DNアーゼ)を添加します。 封入体の再可溶化が必要です。 |
| フレンチプレス |
高圧状態で小さな穴に細胞溶液を通すことで細胞を破砕します。 |
細胞溶液冷やしたフレンチプレスのセルに入れ、圧力をかけたのち、溶出された溶液を回収します。 |
Bacteria, plant cells. |
|
キットベースのサンプル破砕
Sample Grinding Kitは、少量の組織サンプルまたは細胞サンプル(100 mg以下)を破砕してタンパク質抽出できます。このキットは、水に懸濁させた少量の破砕レジンを入れた1.5 mlの微量遠心用チューブ50本で構成されます。サンプル破砕用ペッスル50本もキットに含まれます。プロトコール(図2.2)を始めるには、チューブを遠心分離してレジンをペレット化し水を捨てた後、適切な抽出バッファーと、破砕するサンプルを加えます。使い捨てペッスルでサンプルを破砕した後、遠心分離により細胞片と破砕レジンを除きます。Sample Grinding Kitは、大半の動物組織および植物組織を効率的に破砕します。細胞小器官も破壊されるため、抽出バッファーに可溶性であるすべてのタンパク質が遊離し抽出されます。次に、プロトコールを簡単に示します。詳細なプロトコールについてはキットの使用説明書を参照してください。
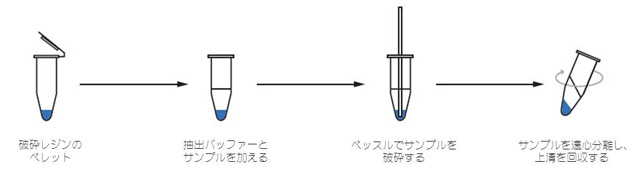
図2.2 Sample Grinding Kitを使用したサンプル破壊
材料
キットに含まれているペッスルと破砕チューブ(破砕レジンを入れた微量遠心チューブ)。
適切な抽出バッファー*
前調製
目的組織をメスでスライスして適切なサイズの組織片にするか、液体窒素で凍結させ乳鉢と乳棒で小さい破片に砕きます。破砕チューブに入れる前に組織を細かく刻んでおくと、サンプルを破砕しやすくなります。
* さまざまな抽出バッファーを提供しています。以下を参照してください。
プロトコール
- 破砕レジンのペレット化
1本以上の破砕チューブを最大速度で短時間遠心分離し、破砕レジンをペレット化します。上清を捨てます。
- 抽出バッファーとサンプルの添加
適切な抽出バッファーを破砕チューブに加え、ボルテックスします。組織または細胞サンプルを添加します。前述したように、抽出バッファーと添加剤は、目的タンパク質を可溶化するとともに化学的活性または酵素活性からタンパク質を保護するものを選択します。
- サンプルをペッスルで細胞/組織を破砕
ペッスルでサンプルを完全に破砕します。必要に応じて抽出バッファーを追加します。
- サンプルの遠心分離と上清の回収
最大速度で破砕チューブを遠心分離し、レジンと細胞片を除きます。済んだ上清を他のチューブに慎重に移します。これで、抽出液をさらにクリーンアップする、またはSDS-PAGE、二次元電気泳動などの方法で分析する準備ができました。
>>タンパク質の安定化
タンパク質サンプル調製ハンドブック目次 |2章 References | 略号と用語、記号解説



