第3章
目的タンパク質の検出性改善(3)
アフィニティーベースの高存在量タンパク質除去(1)
ネガティブクロマトグラフィーとも呼ばれるアフィニティーベースのタンパク質除去は、特定数のタンパク質を除去した画分を得る手法で、標的をさらに絞った形のタンパク質分画とみなせます。この手法では、ある種のアフィニティー結合物質(リガンド)を固相支持体(例:クロマトグラフィー担体)上に固定化し、複雑なタンパク質溶液中に存在する不要なタンパク質と特異的に結合させます。通常、素通り画分のみを次の分析に供します。高存在量タンパク質をサンプルから除去することで、存在量が少ないタンパク質の分析を行いやすくなります。この除去により、他の残留タンパク質のサンプルアプライ量も増大することになります。この手法は一般に非変性条件でのみ使用できます。これは、特異的な相互作用が、リガンドおよび除去対象のタンパク質が保持する三次構造に依存することによります。ある供給源に含まれるタンパク質のうち、分析の目的に関連せず、何らかの形で分析に干渉するタンパク質は、いずれも不要なタンパク質であると考えられます。その一例として、二次元ゲルマップの目的領域をマスキングするタンパク質アイソフォームが挙げられます。他の例としては、植物にきわめて多量に含まれ(全タンパク質の約40%)、緑の葉の中に見られるリブロース二リン酸カルボキシラーゼ/オキシゲナーゼ(RuBisCO)が挙げられます。
しかし、圧倒的に多く使用されているアプリケーションは、動物またはヒトの血漿・血清からの高存在量タンパク質の除去です。このアプリケーションが用いられている理由は、バイオマーカー探索において血漿・血清が重要であること、非変性条件で使用できること、血漿・血清に含まれる高存在量タンパク質は比較的少数であることです(図3.4)。アルブミンと全IgGで構成されるタンパク質集団がヒト血漿の全タンパク質含量の約70%を占め、存在量上位10種類のタンパク質で約90%、上位22種類のタンパク質で99%を構成します (8-9)。単一のステップでこれらのタンパク質のいくつかを除去する場合、一般に複数の抗体を使用するか、他のタンパク質のスキャフォールド(足場)に基づくアフィニティー結合物質を使用します (10-16)。生物種の違いによってタンパク質ホモログの間に若干の違いがあることから、原則として、最適な性能を得るためには生物種に合わせて調整を行う必要があります。
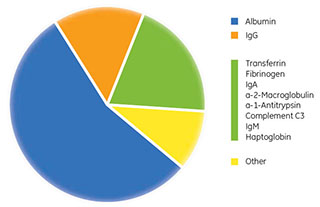
図3.4 高存在量タンパク質除去前のヒト血漿中の各種タンパク質の相対存在量
尿、脳脊髄液などの他の生体液もタンパク質除去法に適しています。このような生体液中のタンパク質存在量の大部分は血漿中に多いタンパク質と同じですが、正確な組成は異なります(詳細データなし)。また、尿中のタンパク質濃度は血漿・血清に比べはるかに低く、除去ステップの前に濃度を上げる必要があります。したがって、全体的な除去効率を高めるために、使用するプロトコールや製品を尿に合わせて変更する必要があります。
アルブミンおよびIgGの除去
高存在量タンパク質を除去するもっとも効率的な方法は抗体などのアフィニティーリガンドを使用する方法ですが、他の手法、例えばブルーセファロース法によるアルブミン除去なども使用できます。
Cytivaは、アルブミンとIgGをヒトの血清および血漿から除去するカラムとして、HiTrap™ Albumin & IgG DepletionカラムおよびAlbumin & IgG Depletion SpinTrap™カラムを提供しています。HiTrap™製品は、シリンジ、ポンプ、またはÄKTA™microなどのクロマトグラフィーシステムと組み合わせて使用できます。SpinTrap™ カラムは、微量遠心機で遠心をかける設計となっています。ヒト血漿・血清のほか、アルブミンとIgGを含む他のサンプルも使用できますが、プロトコールに若干の変更が必要な場合があります。
アルブミンおよびIgGの濃度が正常範囲にあるサンプルからアルブミン含量の95%以上を除去しIgG含量の90%以上を除去するための推奨サンプル容量は、SpinTrap™カラムの場合は約50 μl、HiTrap™カラムの場合は約150 μlです。アルブミンまたはIgG含量が正常範囲より高いサンプルの場合、同じ効率で除去を行うためにはサンプル量を減らすことが望ましく、例えばHiTrap™カラムでは100~125 μl、SpinTrap™カラムでは25 μlとします。
二次元電気泳動前のアルブミンおよびIgG除去の効果を示す例を図3.5に示します。

図3.5
>>目的タンパク質の検出性改善(4)
タンパク質サンプル調製ハンドブック目次 |3章 References | 略号と用語、記号解説

